Page 78 - 《食品科学技术学报》2020年第4期
P. 78
第 38 卷 第 4 期摇 摇 摇 摇 摇 摇 摇 摇 摇 刘晓慧等: 偏甘油酯脂肪酶 PrLip 的重组表达及酶学性质表征 7 3
摇 摇
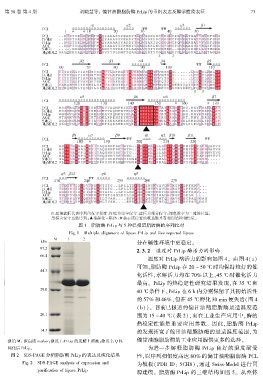
图 1摇 脂肪酶 PrLip 与 5 种已报道脂肪酶的序列比对
Fig. 1摇 Multiple alignment of lipase PrLip and five reported lipase
分在碱性环境中更稳定。
2郾 3郾 2摇 温度对 PrLip 酶活力的影响
温度对 PrLip 酶活力的影响如图 4。 由图 4(a)
可知,脂肪酶 PrLip 在 20 ~ 50 益 时均保持较好的催
化活性,水解活力均在 70% 以上,45 益 时催化活力
最高。 PrLip 的热稳定性研究结果发现,在 35 益 和
40 益条件下,PrLip 在 6 h 内分别保留了其初始活性
的 57% 和 46% ,但在 45 益孵化 30 min 便失活(图 4
(b))。 目前已报道的偏甘油酯脂肪酶最适温度范
围为 15 ~ 40 益 (表 2),而在工业生产应用中,酶的
热稳定性能是重要应用参数。 因此,脂肪酶 PrLip
的发现拓宽了偏甘油酯脂肪酶的最适温度范围,为
泳道 M: 蛋白质 marker;泳道 1:PrLip 的发酵上清液;泳道 2:Q 柱 偏甘油酯脂肪酶的工业应用提供更多的选择。
纯化后 PrLip。 为进一步解释脂肪酶 PrLip 良好的温度耐受
图 2摇 SDS鄄PAGE 分析脂肪酶 PrLip 的表达及纯化结果 性,以序列相似度高达 80% 的偏甘油酯脂肪酶 PCL
Fig. 2摇 SDS鄄PAGE analysis of expression and 为模板(PDB ID: 5CH8),通过 Swiss鄄Model 进行同
purification of lipase PrLip
源建模。 脂肪酶 PrLip 的三维结构如图 5。 从整体