WANG Leqi, WANG Ping. Study on anti-inflammatory and sleep-improving efficacy of Actinidia kolomikta fruit flavonoid extracts based on cellular and Drosophila models[J]. Journal of Food Science and Technology, 2025,43(2):75-85.
现代生活方式越来越多地改变了人们的睡眠,尤其是光污染导致睡眠模式紊乱的问题日益突出。长期或慢性睡眠障碍可能导致生理和神经问题的出现[1]。在一般人群中,睡眠时长与癌症死亡率呈U型关系[2]。近年来,国内外学者对睡眠与炎症反应之间的相关性进行了大量研究[3-4]。昼夜节律紊乱会影响某些炎症细胞因子水平的增加,同时一些细胞因子会诱导睡眠[5]。在多种有明显炎症的败血症动物模型中,睡眠质量明显下降,睡眠深度和时间减少,与此同时,大脑中细胞因子IL-1β、IL-6、TNF-α的mRNA和蛋白水平显著增加[6]。TNF-α和IL-6可以通过不同的信号通路调节炎症进程和睡眠节律[7-8]。
狗枣猕猴桃(Actinidia kolomikta)为猕猴桃科猕猴桃属多年生的大型落叶藤本植物,其果实体型小巧、果皮光滑能直接食用,酸甜可口,是猕猴桃属中最耐寒的品种之一,具有较高的经济价值[9]。早期实验研究提供了猕猴桃属提取物具有抗炎作用的证据[10-11],其多酚提取物能降低TLR2、TLR4、TNF-α和IL-1β表达,抑制肠道炎症[12]。狗枣猕猴桃中富含黄酮,Zhao等[13]从其叶子中发现了一种新型黄酮,具有降血脂作用,可减轻高脂血症大鼠的症状。有报道[14-15]表明,猕猴桃对睡眠具有恢复和调节作用。食用猕猴桃能有效改善自我报告有睡眠障碍的成年人的入睡时间、持续时间和效率[16]。
基于炎症和睡眠之间的相互关系,本研究旨在探究狗枣猕猴桃黄酮提取物从抗炎角度改善睡眠的潜力。构建脂多糖(lipopolysaccharide,LPS)诱导的RAW264.7细胞炎症模型,利用小鼠海马神经元细胞HT22探究AFFE对睡眠相关神经递质GABA和5-HT的影响,以及在睡眠剥夺的野生型黑腹果蝇模型上探讨AFFE对睡眠时长的影响,以期为狗枣猕猴桃的功能食品开发提供更多理论依据。
狗枣猕猴桃,采自黑龙江省伊春市美溪区,由东北林业大学林学院植物资源学科穆立蔷教授鉴定为野生狗枣猕猴桃。
小鼠单核-巨噬细胞白血病细胞株RAW264.7、小鼠海马神经元细胞HT22,江苏晶美生物科技有限公司。野生型黑腹果蝇(Drosophila melanogaster),品系为Canton S,中国科学院上海生命科学院果蝇技术平台,实验对象为12 h内新生黑腹雄蝇。
特级胎牛血清,浙江天杭生物科技股份有限公司;胰蛋白酶-EDTA消化液、LPS、DMEM型高糖培养基,北京索莱宝科技有限公司;一氧化氮试剂盒、Annexin V-FITC细胞凋亡试剂盒、活性氧试剂盒、动物RNA抽提试剂盒、RT-qPCR试剂盒,碧云天生物技术有限公司;IL-6和TNF-α ELISA试剂盒,江苏晶美生物科技有限公司;GABA和5-HT ELISA试剂盒,武汉云克隆科技股份有限公司;Cell Counting Kit-8(CCK-8)试剂、PBS磷酸盐缓冲溶液,安徽白鲨生物科技有限公司;乙醇、亚硝酸钠、硝酸铝、氢氧化钠,分析纯,天津市天力化学试剂有限公司;没食子酸,分析纯,博奥拓达生物科技有限公司;芦丁,分析纯,四川维克奇生物科技有限公司。
FD5-2.5E型冷冻干燥机,北京金西盟仪器有限公司;DS-DZ-1440型超声提取器,无锡鼎实电子科技有限公司;CO2恒温培养箱,美国Thermo Fisher公司;全波长酶标仪,美国伯腾仪器有限公司;DAMS型果蝇活动监测系统,美国Trikinetics公司;高内涵细胞成像分析系统,美国BioTek仪器公司;CytoFLEX型流式细胞仪,美国贝克曼库尔特有限公司;旋转蒸发器,巩义市子华仪器有限公司。Thermo Vanquish超高效液相系统,美国Thermo Fisher公司;Thermo Orbitrap Exploris 120 质谱检测器,美国Thermo Fisher公司。
1.3.1 狗枣猕猴桃黄酮提取物的制备
准确称量狗枣猕猴桃果实,按m(果实)∶V(体积分数为60%的乙醇水溶液)=1 g∶15 mL添加溶剂,60 ℃下300 W超声提取15 min,收集上清液,重复提取2次,合并提取液。提取液浓缩后-20 ℃过夜,经冷冻干燥得到AFFE。
1.3.2 RAW264.7和小鼠神经元细胞HT22细胞培养
通过将特级胎牛血清与高糖培养基1∶10混合制备成细胞完全培养基。细胞接种于含有5 mL完全培养基的直径60 mm细胞培养皿中,置于37 ℃、5% CO2细胞培养箱中培养。当细胞密度约85%时,进行细胞传代。取对数生长期的细胞进行实验。
1.3.3 RAW264.7细胞活力分析
AFFE添加到培养基(含5%胎牛血清)中制备成不同浓度的培养液。RAW264.7 细胞(1×104个细胞/孔)接种在96孔板中,0~500 μg/mL AFFE和LPS(1 μg/mL)培养液共同培养细胞24 h。实验分为空白组(CON)、模型组(LPS)、(25、50、100、250、500 μg/mL)AFFE组(分别记为LPS+25AFFE、LPS+50AFFE、LPS+100AFFE、LPS+250AFFE、LPS+500AFFE)。培养结束后加入100 μL高糖培养基配制的10% CCK-8溶液,避光孵育0.5~1.0 h,酶标仪测定450 nm波长下的吸光度值,并利用式(1)计算细胞活力。
细胞活力![]()
(1)
式(1)中,OD1为对照孔吸光度值,OD2为实验孔吸光度值,OD0为空白孔吸光度值。
1.3.4 RAW264.7细胞凋亡分析
RAW264.7细胞(1×106个细胞/孔)接种6孔板后,AFFE(0、100、250 μg/mL)和LPS共同培养细胞24 h。收集细胞沉淀,加入5 μL Annexin V-FITC和 10 μL碘化丙啶(propidium iodide,PI)重悬细胞沉淀,避光孵育15 min,使用流式细胞术评估活细胞和凋亡细胞群。
1.3.5 RAW264.7细胞NO含量测定
RAW264.7细胞(1×104个细胞/孔)接种96孔板后,AFFE(0、50、100、250 μg/mL)和LPS共同培养细胞24 h。收集细胞上清液,加入Griess试剂反应10 min,反应结束后540 nm下检测吸光度。通过亚硝酸钠(NaNO2)标准曲线计算NO含量。
1.3.6 细胞因子和神经递质生成量测定
RAW264.7细胞(1×104个细胞/孔)接种96孔板后,AFFE(0、50、100、250 μg/mL)和LPS共同培养细胞24 h。吸取细胞上清液,检测细胞因子TNF-α、IL-6生成量。HT22细胞(1×104个细胞/孔)接种96孔板后,AFFE(0、50、100、250 μg/mL)培养细胞24 h。吸取上清液,检测神经递质GABA、5-HT生成量。
1.3.7 细胞因子和神经递质受体mRNA表达的分析
RAW264.7细胞(1×106个细胞/孔)接种6孔板后,AFFE(100 μg/mL、250 μg/mL)和LPS共同培养细胞24 h后通过实时荧光定量反转录PCR(reverse transcription-quantitative real-time PCR,qRT-PCR)检测TNF-α、IL-6 mRNA表达,实时定量PCR引物见表1。HT22细胞(1×106个细胞/孔)接种6孔板后,AFFE(0、50、100、250 μg/mL)培养细胞24 h后检测GABRA1、GABRA2、5-HT1A、5-HT2A mRNA表达。提取细胞总RNA,使用一步法RT-qPCR试剂盒,在反应管中同时进行细胞反转录和荧光定量。各引物序列见表1,反应体系为20 μL,扩增反应条件为反转录50 ℃、20 min;预变性95 ℃、2 min;变性95 ℃、15 s;退火60 ℃、15 min,重复变性与退火步骤40次,结束反应条件95 ℃、15 s,60 ℃、15 s,95 ℃、15 s。实验结果利用2-ΔΔCt 方法计算。
表1 实时定量PCR引物
Tab.1 Primers for real-time quantitative PCR

引物名称 方向 引物序列 (5′ - 3′) TNF-α 正向 ACTCCAGGCGGTGCCTATGT 反向 GTGAGGGTCTGGGCCATAGAA IL-6 正向 GCTACCAAACTGGATATAATCAGG 反向 GCTACCAAACTGGATATAATCAGG GABRA1 正向 GCCAGAAATTCCCTCCCGAA 反向 CATCCCACGCATACCCTCTC GABRA2 正向 GCTCGAAATTCCCTCCCGAA 反向 ACTACACTCTTCCCGTCCCA 5-HT1A 正向 TGATCTCGCTCACTTGGCTC 反向 AAGCGCCGAAAGTGGAGTAG 5-HT2A 正向 GGATGTGCTCTTCTCCACGG 反向 TGGTTCTGGAGTTGAAGCGG GAPDH 正向 GCTACCAAACTGGATATAATCAGG 反向 GTTCACACCGACCTTCACCA
1.3.8 狗枣猕猴桃黄酮提取物活性成分分析
1.3.8.1 总酚含量测定
将AFFE配制成质量浓度为5 mg/mL的样液。
吸取1 mL AFFE加入1 mL 0.25 mol/L福林酚混合均匀,2 min后加入8 mL质量分数为10%的Na2CO3溶液中,蒸馏水定容至25 mL,于常温下避光反应2 h,反应结束后在760 nm下检测吸光度。以没食子酸溶液质量浓度为横坐标,吸光度值为纵坐标绘制标准曲线,得到标准曲线为y=0.052 7x+0.008 4(R2=0.999)。根据标准曲线计算总酚的质量浓度。
1.3.8.2 黄酮含量测定
移取样液1 mL于25 mL容量瓶中,加入体积分数70%的乙醇3 mL、质量分数5%的NaNO2溶液0.75 mL,摇匀,静置6 min,再加入质量分数为 10% 的Al(NO3)3溶液0.5 mL,摇匀,静置6 min,再加入1 mol/L NaOH溶液4 mL,蒸馏水定容至25 mL,混匀,静置15 min,在510 nm处检测吸光度,以芦丁溶液质量浓度为横坐标,吸光度值为纵坐标绘制标准曲线,标准曲线回归方程为y=0.066 4x+0.010 7(R2=0.998)。根据标准曲线计算黄酮的质量浓度。
1.3.8.3 活性成分的LC-MS分析
委托杭州开泰生物技术有限公司对AFFE活性成分进行Orbitrap-LC-MS/MS分析。
色谱条件。色谱柱ACQUITY UPLC HSS T3(150 mm×2.1 mm,1.8 μm);柱温40 ℃;进样量2 μL;流速0.25 mL/min;正离子模式体积分数0.1%甲酸乙腈溶液(B2)和体积分数0.1%甲酸水溶液(A2)为流动相,梯度洗脱程序:0~1 min,8% B2;1~8 min,8%~98% B2;8~10 min,98% B2;10~10.1 min,98%~8% B2;10.1~12 min,8% B2。负离子模式 乙腈(B3)和 5 mmol/L 甲酸铵水溶液(A3)为流动相,梯度洗脱程序:0~1 min,8% B3;1~8 min,8%~98% B3;8~10 min,98% B3;10~10.1 min,98%~8% B3;10.1~12 min,8% B3。
质谱条件。ESI离子源,喷雾电压3 500/2 500 V(+/-)。鞘气40单位,辅助气10单位。毛细管温度325 ℃,一级全扫描分辨率60 000,二级分辨率15 000,扫描范围m/z 100~1 000。
1.3.9 果蝇分组及培养基的配制
将新生黑腹雄蝇按照空白对照(control,CON)组、模型(dark sleep deprivation,SD)组和实验组(AFFE的质量分数为5%、8%、10%,记作AFFE-5、AFFE-8、AFFE-10)给予不同培养基。空白对照组果蝇生活环境为12/12 h明暗交替环境,使用12 h自动循环光照系统(8:00开灯,20:00关灯;12 h明-暗交替循环),温度(25±1) ℃,湿度50%。模型组和实验组果蝇生活环境为全天光照,温湿度同空白对照组。
空白对照组和模型组基础培养基配方:8.46 g麦芽糖、8 g蔗糖、2 g琼脂粉、13.4 g玉米粉、1.6 g大豆粉、5 g酵母粉、1.35 mL丙酸、0.2 g苯甲酸钠、180 mL蒸馏水。实验组培养基是在基础培养基配方中加入不同质量的AFFE,使其终质量分数分别为5%、8%、10%。
1.3.10 果蝇睡眠监测
以3日龄雄蝇为实验对象,收集12 h内新生雄蝇,饲养在基础培养基中。饲养到第3日时20:00分别转移到含有AFFE的实验培养基,24 h光照下培养15 d。模型组移入不含药物的基础培养基中,24 h光照下培养15 d。空白对照组移入不含药物的基础培养基中,12 h 明-暗交替循环环境下培养15 d。每组5管,每管32只,培养基每3 d进行1次更换。培养后的第15日20:00将果蝇转移至睡眠检测管中,适应一晚上后记录第16日8:00至17日8:00果蝇的睡眠时间。最终取每管中健康存活的20只果蝇进行数据分析。
所有实验重复操作3次,符合正态分布的计量数据用![]() 表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法。采用Origin 24.0软件绘图。P<0.05表示差异显著,P<0.01表示差异极显著。
表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法。采用Origin 24.0软件绘图。P<0.05表示差异显著,P<0.01表示差异极显著。
AFFE对巨噬细胞RAW264.7的细胞活力和细胞凋亡影响见图1。
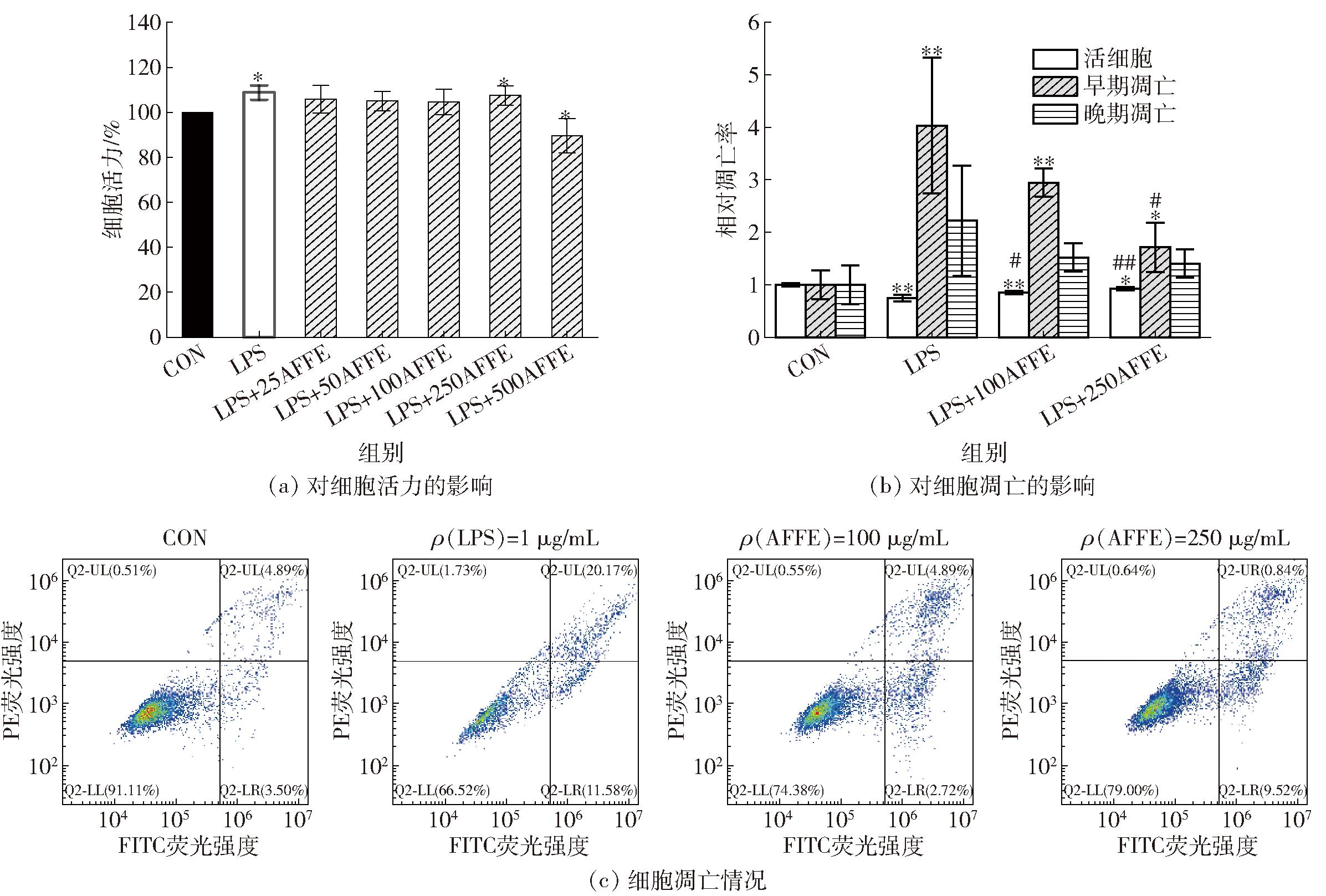
*、#代表与空白对照组、模型组之间差异显著(P<0.05),**、##代表与空白对照组、模型组之间差异极显著(P<0.01)。
图1 AFFE对巨噬细胞RAW264.7的细胞活力和细胞凋亡的影响
Fig.1 Effect of AFFE on cell viability and apoptosis of macrophage RAW264.7
由图1(a)可知,用LPS刺激RAW264.7细胞,除500 μg/mL外,AFFE对细胞未表现出细胞毒害作用。LPS阳性对照组细胞活力达(108.77±3.18)%,细胞活力增加、伪足明显,表明增殖异常。为进一步评价AFFE对RAW264.7细胞炎症模型的影响,进行了Annexin V-FITC/PI双染色分析。LPS具有增加巨噬细胞凋亡率的能力,特别是在RAW264.7细胞系中[17]。由图1(b)和图1(c)可知,LPS显著诱导RAW264.7细胞凋亡,早期凋亡和晚期凋亡分别是空白对照组的(4.03±1.29)和(2.22±1.05)倍。LPS的诱导作用通常与不同的过程有关,尤其是NO和TNF-α等促炎因子的分泌。一旦这些因子产生,便可以激活并参与细胞凋亡早期和晚期的不同途径[18]。AFFE预处理可以减少RAW264.7细胞受LPS诱导凋亡的影响,250 μg/mL AFFE抗凋亡效果最好。这与先前的研究[19-20]结果一致,即猕猴桃属提取物具有抗凋亡作用。
AFFE对RAW264.7细胞炎症模型中NO、TNF-α和IL-6的影响见图2。由图2可知,AFFE呈剂量依赖性降低RAW264.7细胞炎症模型中NO、TNF-α和IL-6的水平。RAW264.7细胞经LPS诱导后NO产生量(36.35±1.72) μmol/L,250 μg/mL AFFE实验组细胞NO产生量(18.03±2.57) μmol/L,与LPS阳性对照组有极显著差异(P<0.01)。另一方面,250 μg/mL AFFE处理后对RAW264.7细胞中NO、TNF-α和IL-6生成的抑制率分别高达62.71%、47.38%和65.53%,均与LPS阳性对照组有极显著差异(P<0.01)。NO、TNF-α和IL-6等炎症介质参与自分泌和/或旁分泌作用的各种信号通路[21-22],通过级联反应激活或增加其他促炎因子以及促炎酶的表达来加速炎症发生[23]。因此,AFFE抑制LPS诱导的炎症反应可能是通过下调NO、TNF-α和IL-6的生成发挥作用。
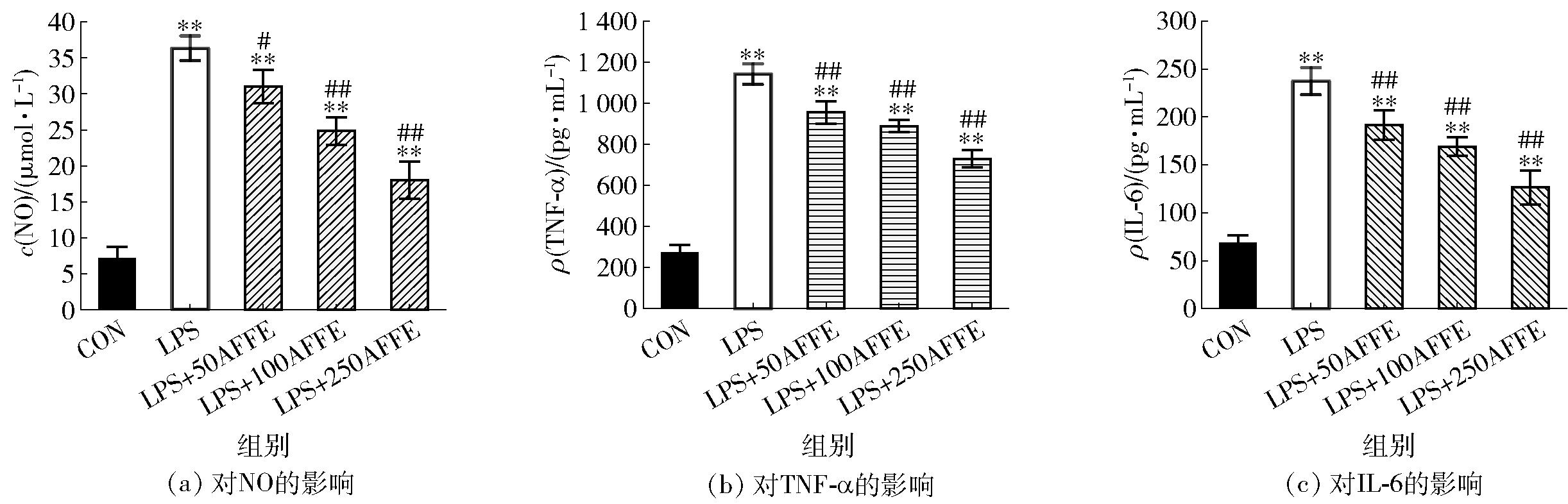
*、#分别代表与空白对照组、模型组之间差异显著(P<0.05);**、##分别代表与空白对照组、模型组之间差异极显著(P<0.01)。
图2 AFFE对RAW264.7细胞NO、TNF-α和IL-6生成的影响
Fig.2 Effects of AFFE on NO, TNF-α and IL-6 production in RAW264.7 cells
AFFE对RAW264.7炎症细胞模型TNF-α和IL-6 mRNA表达量的影响见图3。由图3可知,LPS诱导后细胞的TNF-α和IL-6 mRNA表达量皆显著上调,与空白对照组差异极显著(P<0.01)。250 μg/mL AFFE处理后,TNF-α和IL-6细胞因子mRNA的相对表达量分别为16.24±1.67、7.31±1.04,均与LPS组有极显著差异(P<0.01)。AFFE下调了RAW264.7细胞中TNF-α和IL-6的mRNA表达,结果进一步支持AFFE可以降低LPS诱导RAW264.7细胞的炎症反应。
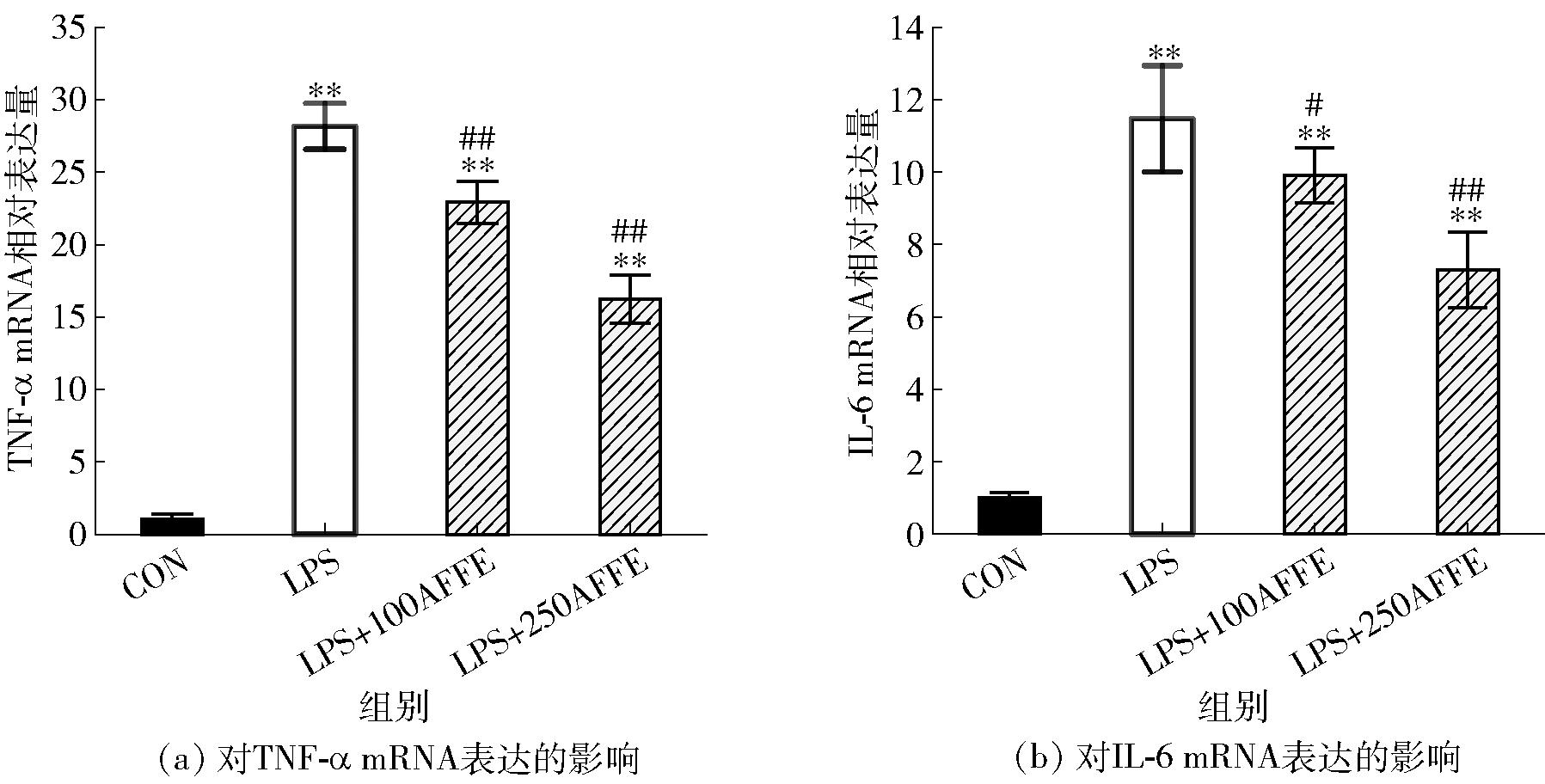
*、#分别代表与空白对照组、模型组之间差异显著(P<0.05);**、##分别代表与空白对照组、模型组之间差异极显著(P<0.01)。
图3 AFFE对RAW264.7细胞TNF-α和IL-6 mRNA表达的影响
Fig.3 Effect of AFFE on expression of TNF-α and IL-6 mRNA in RAW264.7 cells
AFFE对小鼠海马神经元细胞HT22睡眠相关神经递质GABA和5-HT生成的影响见表2。由表2可知,AFFE处理能促进HT22细胞内GABA和5-HT生成量剂量依赖性增加。当AFFE添加量为250 μg/mL时,GABA和5-HT的生成量相较空白对照组有极显著差异(P<0.01)。大量证据表明全身炎症与中枢5-HT功能之间存在联系[24],许多不同类型免疫细胞如T细胞、巨噬细胞、肥大细胞均能表达、储存、应答和/或运输血清素[25]。槲皮素通过其抗氧化和抗炎活性降低神经兴奋性毒性和增加5-HT水平[26]。关键抗炎细胞因子IL-10增强神经节胶质瘤中GABA电流,促炎细胞因子IL-1β降低GABA电流幅度,并阻止IL-10的调节作用,炎症细胞因子能调节GABA能系统[27]。因此,AFFE促进GABA和5-HT生成可能与其抗炎作用有关。
表2 AFFE对HT22细胞 GABA和5-HT 生成的影响
Tab.2 Effect of AFFE on GABA and 5-HT production in HT22 cells

组别 ρ(GABA) / (pg·mL -1 ) ρ(5-HT) / (ng·mL -1 ) 空白对照组 91. 58±4. 91 81. 20±6. 40 50 μg / mL 实验组 94. 28±9. 81 86. 49±5. 58 100 μg / mL 实验组 102. 55±6. 48 ∗∗ 89. 47±5. 24 250 μg / mL 实验组 113. 32±8. 18 ∗∗ 103. 02±4. 04 ∗∗
*代表与空白对照组之间差异显著(P<0.05),**代表与空白对照组差异极显著(P<0.01)。
AFFE对GABA和5-HT受体mRNA表达的影响见表3。由表3可知,与空白对照组比较,50 μg/mL AFFE处理组细胞中5-HT2A mRNA表达显著上调(P<0.05)。当以250 μg/mL剂量时,除5-HT1A的mRNA表达与空白组差异不显著外(P>0.05),HT22细胞中GABRA1、GABRA2的mRNA表达均与空白对照组差异极显著(P<0.01),5-HT2A mRNA表达与空白对照组差异显著(P<0.05)。GABA和5-HT受体mRNA的上调进一步印证了AFFE对GABA和5-HT生成的促进作用。
表3 AFFE对HT22细胞GABA和5-HT受体基因表达的影响
Tab.3 Effect of AFFE on GABA and 5-HT receptor gene expression in HT22 cells

组 别 G A B R A 1 G A B R A 2 5 - H T 1 A 5 - H T 2 A 空 白 对 照 组 1 . 0 0 ± 0 . 1 4 1 . 0 0 ± 0 . 1 1 1 . 0 0 ± 0 . 0 6 1 . 0 1 ± 0 . 1 7 5 0 μ g / m L 实 验 组 1 . 1 5 ± 0 . 1 3 1 . 0 9 ± 0 . 1 1 1 . 0 4 ± 0 . 0 6 1 . 1 8 ± 0 . 1 1 1 0 0 μ g / m L 实 验 组 1 . 1 8 ± 0 . 1 5 1 . 1 6 ± 0 . 1 6 1 . 0 2 ± 0 . 1 0 1 . 2 0 ± 0 . 1 3 2 5 0 μ g / m L 实 验 组 1 . 3 6 ± 0 . 2 0 ∗ ∗ 1 . 2 9 ± 0 . 1 8 ∗ ∗ 1 . 0 8 ± 0 . 1 0 1 . 2 8 ± 0 . 2 0
*代表与空白对照组之间差异显著(P<0.05),**代表与空白对照组差异极显著(P<0.01)。
经测定,AFFE中总多酚含量为(375.71± 9.49)mg/100 g,黄酮含量为(215.61± 11.50)mg/100 g。在Zuo等[28]研究中,狗枣猕猴桃提取物多酚含量比软枣猕猴桃和中华猕猴桃分别多18.74%和271.48%,说明狗枣猕猴桃提取物富含多酚生物活性物质,具有很高的营养价值和药理活性。
根据质谱数据库对AFFE组成进行分析,AFFE的LC-MS/MS总离子流色谱图见图4;AFFE化合物组成信息结果见表4。由表4可知,在AFFE中检测出了33种活性成分,其中有14种黄酮类物质,在总丰度中占比58.61%,丰度排名前5的物质中有4种属于黄酮,分别是木樨草素7-O-β-D-葡萄糖苷、芦丁、儿茶素、表儿茶素,说明AFFE主要成分为黄酮类物质。根据之前的研究[29-30],槲皮素可抑制不同细胞中LPS诱导的IL-6、IL-1β、IL-8和TNF-α水平。木樨草素能改变巨噬细胞M1/M2极化,下调p-STAT3和上调p-STAT6发挥抗炎作用[31]。芦丁通过调节TLR4-MyD88-TRAF6-NF-κB 信号通路,降低诱导型一氧化氮合酶(iNOS)基因和蛋白表达水平,对LPS刺激的RAW264.7细胞产生抗炎作用[32]。因此,AFFE的抗炎作用可能与其蕴含的黄酮类物质有关。
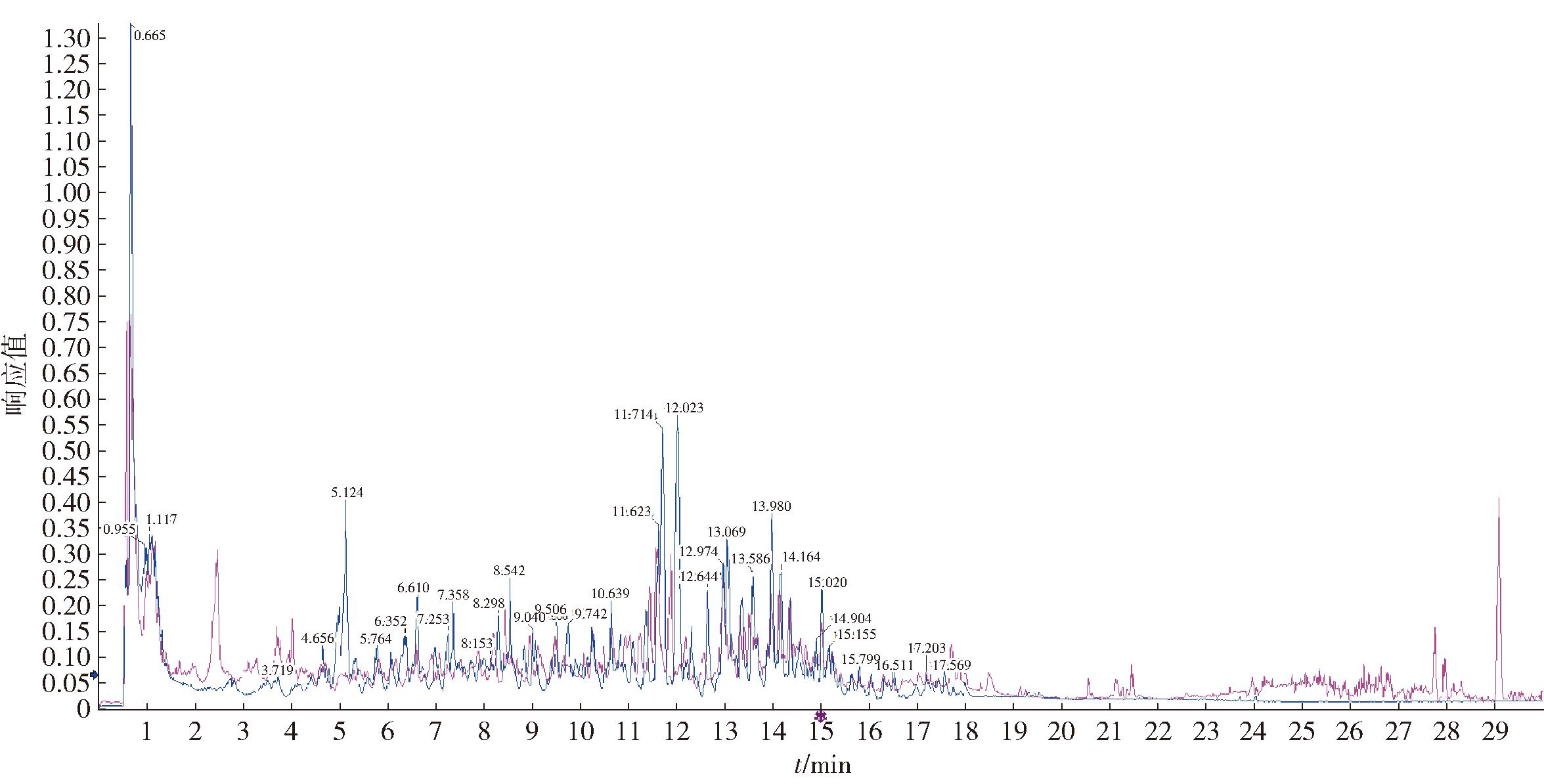
图4 AFFE的LC-MS/MS总离子流色谱
Fig.4 LC-MS/MS total ion flow chromatogram of AFFE
表4 AFFE的LC-MS/MS 分析结果
Tab.4 Analysis results of AFFE by LC-MS/MS

序号 名称 化学式 m/ z Rt / s 相对丰度/ % 1 白矢车菊素 C15H14O7 307. 081 2 214. 3 0. 069 1 2 槲皮素 3-(2G-木糖基芸香糖苷) C32H38O20 743. 196 6 260. 0 1. 025 7 3 飞燕草素 3-O-β-D-桑布双糖苷 C26H29O16 597. 150 7 269. 4 1. 901 5 4 天竺葵素 3-槐糖苷 C27H31O15 595. 163 1 289. 0 2. 969 1 5 抗坏血酸 C6H8O6 177. 039 4 53. 8 3. 910 2 6 柚皮素 C15H12O5 273. 075 9 283. 4 0. 405 8 7 木樨草素 C15H10O6 287. 055 3 298. 4 3. 338 2 8 表儿茶素 C15H14O6 291. 084 6 257. 7 8. 436 7 9 槲皮素 C15H10O7 303. 049 5 285. 7 7. 852 8 10 染料木苷 C21H20O10 432. 236 6 463. 4 3. 679 1 11 异阿魏酸 C10H10O4 195. 065 3 217. 7 1. 425 8 12 鞣花酸 C14H6O8 303. 013 3 293. 1 0. 062 5 13 鼠李素 C16H12O7 317. 064 5 302. 7 0. 383 9 14 肉豆蔻醚 C11H12O3 193. 086 3 229. 4 0. 301 0 15 苏巴菲林 C14H20N2O3 265. 154 9 243. 8 1. 751 4 16 绿原酸 C16H18O9 355. 101 5 159. 8 13. 578 6 17 槲皮素 3-(6″-丙二酰葡萄糖苷) C24H22O15 551. 100 4 292. 8 5. 180 4 18 原花青素 B2 C30H26O12 579. 143 6 245. 6 3. 652 9 19 橙皮素 7-新橙皮糖苷 C28H34O15 611. 193 5 277. 0 0. 198 1 20 矢车菊素 3-O-芸香糖苷 5-O-β-D-葡萄糖苷 C33H41O20 757. 228 7 272. 5 0. 743 6 21 山柰酚-3-O-芸香糖苷 C27H30O15 593. 140 6 286. 5 1. 149 3 22 橙皮素 7-O-葡萄糖苷 C22H24O11 463. 123 5 300. 4 0. 006 5 23 (2S)-甘草素 C15H12O4 255. 066 9 455. 1 0. 219 2
续表4

序号 名称 化学式 m/ z Rt / s 相对丰度/ % 24 儿茶素 C15H14O6 289. 071 9 258. 3 5. 670 1 25 花旗松素 C15H12O7 285. 040 9 347. 2 0. 146 7 26 没食子酸 C7H6O5 169. 014 7 84. 5 0. 7394 27 ( -)-表没食子儿茶素 C15H14O7 306. 075 4 46. 0 1. 160 4 28 圣草酚 C15H12O6 287. 058 9 343. 9 0. 110 8 29 木樨草素 7-O-β-D-葡萄糖苷 C21H20O11 447. 097 8 296. 2 14. 074 6 30 反式阿魏酸 C10H10O4 195. 065 4 284. 3 1. 325 9 31 咖啡酸 C9H8O4 181. 050 1 159. 0 1. 293 8 32 3-(3,4-二羟基-5-甲氧基)-2-丙烯酸 C10H10O5 209. 045 5 278. 6 0. 047 6 33 芦丁 C27H30O16 611. 157 2 277. 0 13. 188 9
在50~250 μg/mL,选取相同浓度AFFE,以对炎症介质NO、TNF-α和IL-6分泌、神经递质GABA和5-HT生成的影响进行相关性分析,结果见图5。
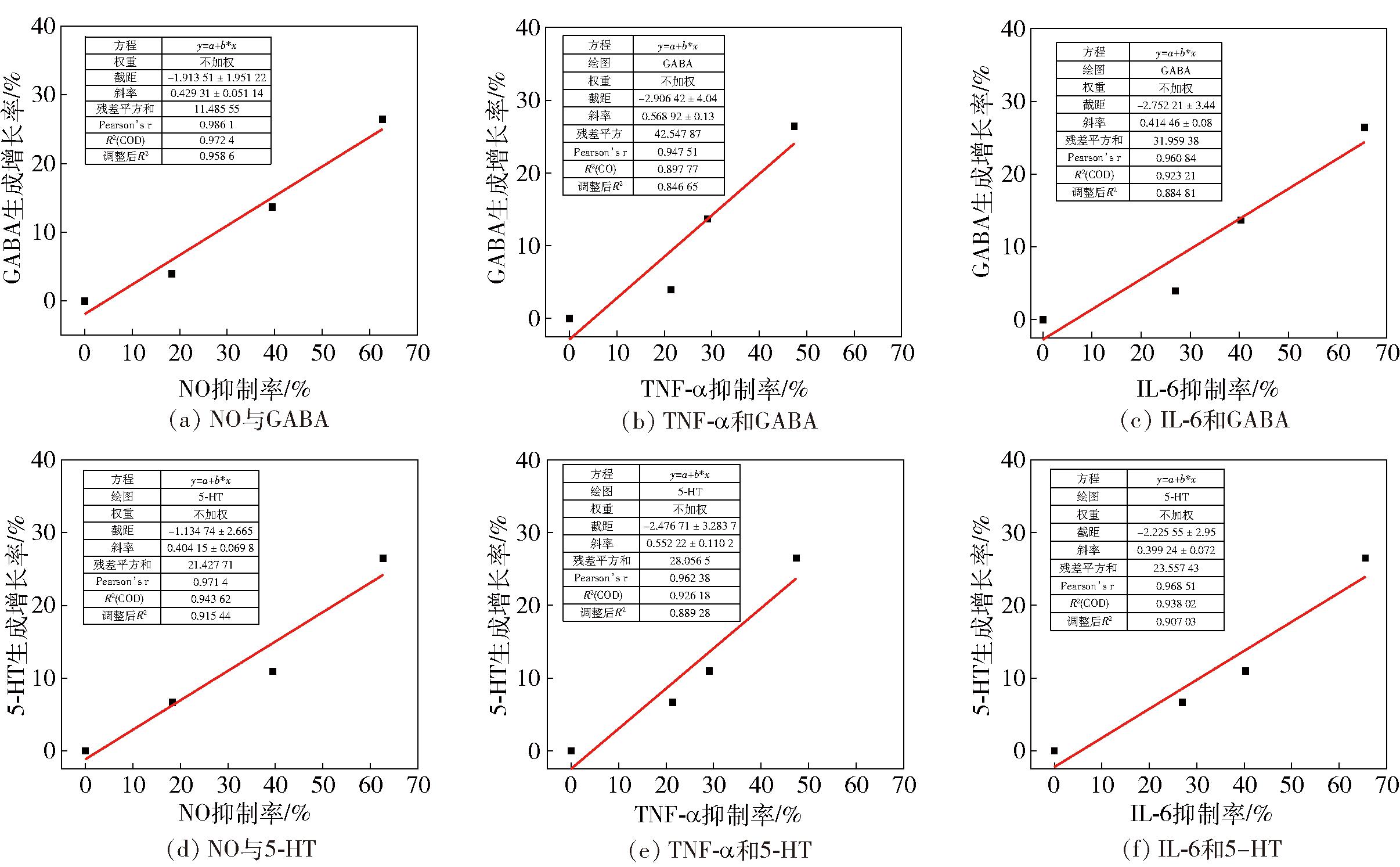
图5 炎症介质NO、TNF-α和IL-6抑制率与神经递质GABA和5-HT生成率的相关性
Fig.5 Correlation of inflammatory mediator NO, TNF-α and IL-6 inhibition rates with neurotransmitter GABA and 5-HT production rates
图5显示了AFFE对GABA和5-HT生成增长率与对炎症介质NO、TNF-α和IL-6分泌抑制率之间的相关性。线性相关方程和相关系数依次为y=0.429 3x-1.913 5(R2=0.972 4),y=0.588 9x-2.906 4(R2=0.897 8),y=0.414 5x-2.752 2(R2=0.923 2),y=0.404 1x-1.134 7(R2=0.943 6),y=0.552 2x-2.476 7(R2=0.928 2),y=0.399 2x-2.225 6(R2=0.938 0)。由相关性方程以及图5曲线变化趋势可知,AFFE对NO、TNF-α和IL-6分泌的抑制作用与对神经递质GABA和5-HT生成的促进作用呈正相关关系。随着AFFE浓度的升高,AFFE对NO、TNF-α和IL-6分泌抑制能力增强,GABA和5-HT生成也增多,神经递质GABA和5-HT的产生量与AFFE显著的抗炎能力呈正相关。GABA和5-HT是已知与睡眠调控密切相关的神经递质,在昼夜节律、入睡和觉醒等关键睡眠过程中起重要的调节作用[33]。这表明AFFE的助眠作用与其显著的抗炎能力相关。
在睡眠模式上果蝇与人类具有高度一致性,有着类似的为了适应地球自转产生的昼夜更替而进化出的生物节律。人为营造光照环境,会影响果蝇的睡眠。AFFE对24 h光照果蝇睡眠时间的影响见图6。由图6可知,与CON组果蝇全天睡眠时间(841.57±113.32) min比较,SD组果蝇全天睡眠时间只有(725.62±142.00) min,睡眠剥夺成功(P<0.01)。光照严重剥夺了果蝇的夜晚睡眠时间,果蝇昼夜节律紊乱;5%、8%、10% AFFE培养均能延长果蝇睡眠时间,尤其是夜晚睡眠时间。5% AFFE实验组果蝇全天、夜晚睡眠时间仍与空白对照组有极显著差异(P<0.01),睡眠延长效果不显著。8% AFFE实验组果蝇夜晚睡眠时间延长,与SD组有显著差异(P<0.05)。10% AFFE实验组果蝇夜晚睡眠时间、全天睡眠时间皆延长,与SD组有显著差异(P<0.05)。
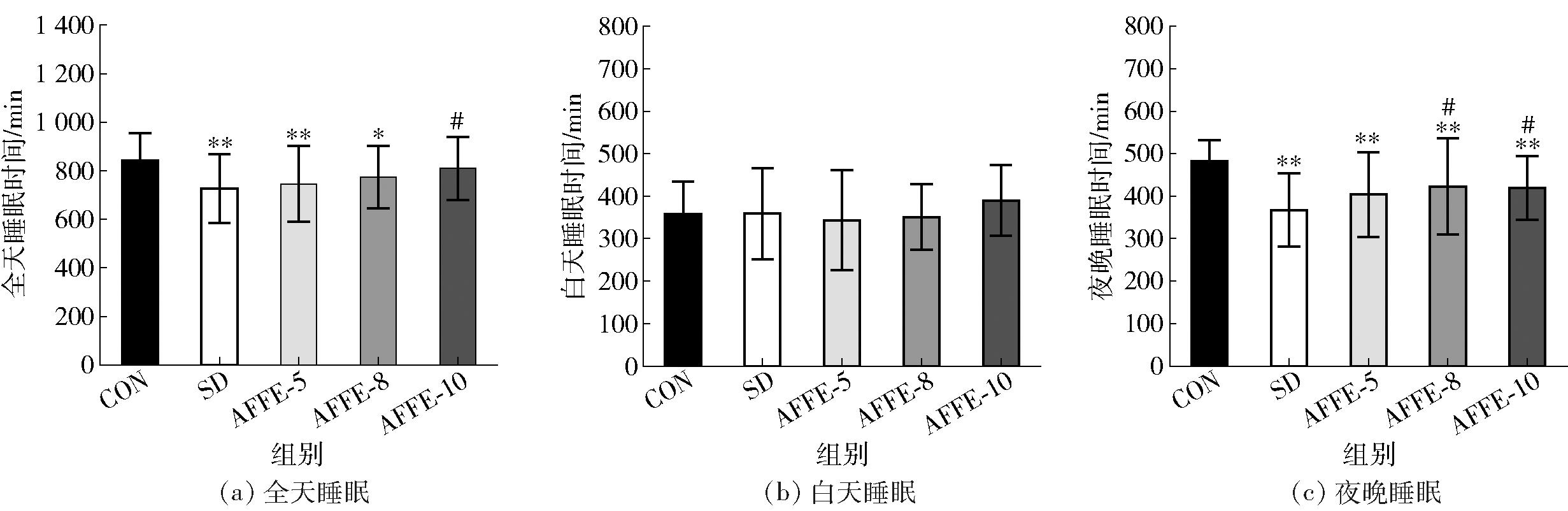
*、#分别代表与空白对照组、模型组之间差异显著(P<0.05);**、##分别代表与空白对照组、模型组之间差异极显著(P<0.01)。
图6 AFFE对果蝇睡眠时间的影响
Fig.6 Effect of AFFE on sleep duration of Drosophila melanogaster
研究利用细胞和果蝇模型,通过评价AFFE的抗炎作用、对神经递质生成的影响,探讨了其对果蝇的助眠效果。结果表明,AFFE通过抑制RAW264.7炎症介质的产生、下调TNF-α和IL-6 mRNA的表达、减少细胞凋亡而发挥抗炎活性;AFFE可促进HT22中与睡眠相关的神经递质GABA和5-HT的生成及其受体mRNA的表达;GABA和5-HT与神经元上的受体结合,直接或间接抑制神经元的兴奋性而达成助眠效果;24 h光照诱导果蝇睡眠剥夺,AFFE可延长果蝇全天睡眠时间,表明AFFE同时具有抗炎和助眠作用。相关性分析显示,狗枣猕猴桃黄酮提取物可以通过降低炎症水平来改善睡眠。狗枣猕猴桃黄酮提取物作为天然产物,具有应用于保健食品和食品添加剂的较大潜力。
[1] BISHIR M, BHAT A, ESSA M M, et al. Sleep deprivation and neurological disorders[J]. BioMed Research International, 2020, 2020: 5764017.
[2] LI Y J, CAI S F, LING Y X, et al. Association between total sleep time and all cancer mortality: non-linear dose-response meta-analysis of cohort studies[J]. Sleep Medicine, 2019, 60: 211-218.
[3] IRWIN M R. Sleep and inflammation: partners in sickness and in health[J]. Nature Reviews Immunology, 2019, 19(11): 702-715.
[4] IRWIN M R, OLMSTEAD R, CARROLL J E. Sleep disturbance, sleep duration, and inflammation: a systematic review and meta-analysis of cohort studies and experimental sleep deprivation[J]. Biological Psychiatry, 2016, 80(1): 40-52.
[5] VELER H. Sleep and inflammation: bidirectional relationship[J]. Sleep Medicine Clinics, 2023, 18(2): 213-218.
[6] GRANGER J I, RATTI P L, DATTA S C, et al. Sepsis-induced morbidity in mice: effects on body temperature, body weight, cage activity, social behavior and cytokines in brain[J]. Psychoneuroendocrinology, 2013, 38(7): 1047-1057.
[7] FRANK M G. The Role of Glia in Sleep Regulation and Function[M]//LANDOLT H P, DIJK D J. Sleep-wake neurobiology and pharmacology. Cham: Springer International Publishing, 2019: 83-96.
[8] JIN R R, CHEUNG C N, WONG C H Y, et al. Sleep quality mediates the relationship between systemic inflammation and neurocognitive performance[J]. Brain, Behavior, &Immunity-Health, 2023, 30: 100634.
[9] 苏玉彤, 张增江, 刘长武. 狗枣猕猴桃利用价值及开发前景[J]. 特种经济动植物, 2014, 17(6): 46-47. SU Y T, ZHANG Z J, LIU C W. Utilization value and development prospect of Actinidia arguta[J]. Special Economic Animal and Plant, 2014, 17(6): 46-47.
[10] EDMUNDS S J, ROY N C, LOVE D R, et al. Kiwifruit extracts inhibit cytokine production by lipopolysaccharide-activated macrophages, and intestinal epithelial cells isolated from IL10 gene deficient mice[J]. Cellular Immunology, 2011, 270(1): 70-79.
[11] PENG Y Y, CORDINER S B, SAWYER G M, et al. Kiwifruit with high anthocyanin content modulates NF-κB activation and reduces CCL11 secretion in human alveolar epithelial cells[J]. Journal of Functional Foods, 2020, 65: 103734.
[12] YUAN M L, CHEN X, SU T X, et al. Supplementation of kiwifruit polyphenol extract attenuates high fat diet induced intestinal barrier damage and inflammation via reshaping gut microbiome[J]. Frontiers in Nutrition, 2021, 8: 702157.
[13] ZHAO X Z, LI X W, JIN Y R, et al. Hypolipidemic effects of kaempferide-7-O-(4″-O-acetylrhamnosyl)-3-O-rutinoside in hyperlipidemic rats induced by a high-fat diet[J]. Molecular Medicine Reports, 2012, 5(3): 837-841.
[14] DOHERTY R, MADIGAN S, NEVILL A, et al. The impact of kiwifruit consumption on the sleep and reco-very of elite athletes[J]. Nutrients, 2023, 15(10): 2274.
[15] KANON A P, GIEZENAAR C, ROY N C, et al. Acute effects of fresh versus dried Hayward green kiwi fruit on sleep quality, mood, and sleep-related urinary metabolites in healthy young men with good and poor sleep quality[J]. Frontiers in Nutrition, 2023, 10: 1079609.
[16] LIN H H, TSAI P S, FANG S C, et al. Effect of kiwifruit consumption on sleep quality in adults with sleep problems[J]. Asia Pacific Journal of Clinical Nutrition, 2011, 20(2): 169-174.
[17] GEORGE L, RAMASAMY T, SIRAJUDEEN K, et al. LPS-induced apoptosis is partially mediated by hydrogen sulphide in RAW 264.7 murine macrophages[J]. Immunological Investigations, 2019, 48(5): 451-465.
[18] XAUS J, COMALADA M, VALLEDOR A F, et al. LPS induces apoptosis in macrophages mostly through the autocrine production of TNF-alpha[J]. Blood, 2000, 95(12): 3823-3831.
[19] GAO Z W, DENG G H, LI Y J, et al. Actinidia chinensis Planch prevents proliferation and migration of gastric cancer associated with apoptosis, ferroptosis activation and mesenchymal phenotype suppression[J]. Biomedicine &Pharmacotherapy, 2020, 126: 110092.
[20] CHO C H, JUNG Y S, KIM J M, et al. Neuroprotective effects of Actinidia eriantha cv. Bidan kiwifruit on amyloid beta-induced neuronal damages in PC-12 cells and ICR mice[J]. Journal of Functional Foods, 2021, 79: 104398.
[21] WANG T T, HE C Q, YU X J. Pro-inflammatory cytokines: new potential therapeutic targets for obesity-rela-ted bone disorders[J]. Current Drug Targets, 2017, 18(14): 1664-1675.
[22] HU F L, LOU N, JIAO J Y, et al. Macrophages in pancreatitis: mechanisms and therapeutic potential[J]. Biomedecine &Pharmacotherapie, 2020, 131: 110693.
[23] SOUFLI I, TOUMI R, RAFA H, et al. Overview of cytokines and nitric oxide involvement in immuno-pathogenesis of inflammatory bowel diseases[J]. World Journal of Gastrointestinal Pharmacology and Therapeutics, 2016, 7(3): 353-360.
[24] COUCH Y, MARTIN C J, HOWARTH C, et al. Systemic inflammation alters central 5-HT function as determined by pharmacological MRI[J]. NeuroImage, 2013, 75: 177-186.
[25] WU H, DENNA T H, STORKERSEN J N, et al. Beyond a neurotransmitter: the role of serotonin in inflammation and immunity[J]. Pharmacological Research, 2019, 140: 100-114.
[26] KHAN K, NAJMI A K, AKHTAR M. A natural pheno-lic compound quercetin showed the usefulness by targeting inflammatory, oxidative stress markers and augment 5-HT levels in one of the animal models of depression in mice[J]. Drug Research, 2019, 69(7): 392-400.
[27] RUFFOLO G, ALFANO V, ROMAGNOLO A, et al. GABAA receptor function is enhanced by Interleukin-10 in human epileptogenic gangliogliomas and its effect is counteracted by Interleukin-1β[J]. Scientific Reports, 2022, 12(1): 17956.
[28] ZUO L L, WANG Z Y, FAN Z L, et al. Evaluation of antioxidant and antiproliferative properties of three Actini-dia (Actinidia kolomikta, Actinidia arguta, Actinidia chinensis) extracts in vitro[J]. International Journal of Molecular Sciences, 2012, 13(5): 5506-5518.
[29] XIONG G, JI W S, WANG F, et al. Quercetin inhibits inflammatory response induced by LPS from porphyromonas gingivalis in human gingival fibroblasts via suppressing NF- κB signaling pathway[J]. BioMed Research International, 2019, 2019: 6282635.
[30] TANG J, DIAO P, SHU X H, et al. Quercetin and quercitrin attenuates the inflammatory response and oxidative stress in LPS-induced RAW264.7 cells: in vitro assessment and a theoretical model[J]. BioMed Research International, 2019, 2019(1): 7039802.
[31] WANG S X, CAO M, XU S H, et al. Luteolin alters macrophage polarization to inhibit inflammation[J]. Inflammation, 2020, 43(1): 95-108.
[32] TIAN C, LIU X, CHANG Y, et al. Rutin prevents inflammation induced by lipopolysaccharide in RAW 264.7 cells via conquering the TLR4-MyD88-TRAF6-NF-κB signalling pathway[J]. Journal of Pharmacy and Pharmacology, 2021, 73(1): 110-117.
[33] HONG K B, PARK Y, SUH H J. Sleep-promoting effects of a GABA/5-HTP mixture: behavioral changes and neuromodulation in an invertebrate model[J]. Life Sciences, 2016, 150: 42-49.