近年来,随着工业化和城镇化水平的提高,居民的生活方式和饮食习惯等发生了明显的变化,炎症性肠病的发病率逐年升高[1]。根据中国疾病预防控制中心数据:2025年我国的炎症性肠病(inflammatory bowel disease,IBD)发病率将达到107.1/10万,成为影响我国居民健康的常见疾病[2]。因此,发掘具有缓解、治疗炎症性肠病的功能因子,降低肠炎的发病风险成为近年研究热点。
脂磷壁酸 (lipoteichoic acid, LTA)是一种来自革兰氏阳性菌细胞壁的核糖醇聚合物。近期的研究发现,多株益生菌的脂磷壁酸具有良好的抗炎和免疫调节活性[3-5],是潜在的抗肠炎的功能因子。不同革兰氏阳性菌的脂磷壁酸结构有所不同,例如植物乳杆菌相比副干酪乳杆菌,其脂磷壁酸氨基含量更低,且不含有饱和酰基脂肪酸,结构上的差异意味着不同菌株来源的脂磷壁酸活性可能不同[6]。植物乳杆菌K8的脂磷壁酸能够降低福氏志贺菌肽聚糖诱发的肠上皮细胞炎性因子TNF-α和IL-8水平[7];副干酪乳杆菌D3-5的脂磷壁酸能够缓解老化相关的肠道渗漏,防止病原菌入侵[8];保加利亚乳杆菌脂磷壁酸表现出抑制脂多糖(lipopolysaccharide,LPS)结合Kupffer细胞TLR4受体的活性[9];在不同来源的巨噬细胞系中[10-12],脂磷壁酸均能够通过调节NO合成减轻细胞炎症反应。在已报道的益生菌中,植物乳杆菌脂磷壁酸表现出了一些突出的优点。首先其抗性好、生物量高,容易获得较高的脂磷壁酸的产率[13];其次,植物乳杆菌脂磷壁酸的NH基团更少,致敏性低但抗炎活性强[6];另外,植物乳杆菌在众多传统发酵食品中广泛存在,安全性高[14]。
为了明确脂磷壁酸对肠炎的缓解作用,本研究以实验室从藏灵菇中分离和鉴定的一株具有良好抑菌、抗炎和免疫调节活性[15-16]的植物乳杆菌GSLP-7为实验菌株,分离其脂磷壁酸干预LPS诱导的Balb/c雄性肠炎小鼠,通过检测小鼠肠道炎症反应、组织损伤、肠道内环境改善和关键免疫通路蛋白的表达变化,探究植物乳杆菌脂磷壁酸对小鼠肠炎的缓解作用,为脂磷壁酸在肠炎的治疗和应用提供参考。
1 材料与方法
1.1 材料与试剂
SPF级雄性Balb/c小鼠:6周龄,北京天宇科航生物科技有限公司,实验动物使用许可证号:SCXK(京)2019-0010,实验动物由斯贝福(北京)生物技术有限公司实验动物伦理委员会批准,伦理号:2019010501。动物实验遵守中国实验动物管理立法的规定和一般建议进行。动物适应3 d环境,饲养环境保持恒温(22~24 ℃),并保持每天亮-暗循环时间各半,小鼠可以自由饮水。
植物乳杆菌GSLP-7,由北京工商大学乳品实验室和中国微生物菌种保藏管理委员会普通微生物中心(CGMCC17171)保藏;MRS培养基,国药化学试剂有限公司; LPS、脂磷壁酸标品,美国Sigma公司;虎地肠溶胶囊,安徽九方制药有限公司;TNF-α、IL-6、IL-1β、IL-12、IL-10 ELISA试剂盒,美国RayBiotech公司;无水乙醇、二甲苯、中性树脂,国药集团化学试剂有限公司;苏木素伊红染色液(hematoxylin-eosin staining,HE),北京雷根生物技术有限公司;髓过氧化物酶(myeloperoxidase,MPO)试剂盒、Anti-GAPDH抗体(Abcam)、TLR4抗体、MyD88抗体、p44/42 MAPK (Erk1/2)小鼠单克隆抗体、NF-κB p65 小鼠单克隆抗体、Phospho-NF-κB p65 (Ser536)抗体、Goat anti-Rabbit IgG (H+L)、HRP Conjugated、Goat anti-mouse IgG (H+L)、HRP Conjugated,天德悦(北京)生物科技有限责任公司;BCA蛋白定量试剂盒、辛基-琼脂糖凝胶CL-4B,北京索莱宝科技有限公司;Prestained Protein Ladder,美国Fermentas公司;PVDF转印膜、ECL化学发光试剂盒,德国Millipore公司。
1.2 仪器与设备
MLS-3750型高压蒸汽灭菌锅,日本Sanyo公司;BCN-1360B型超净工作台,北京东联哈尔仪器公司;HWS12型恒温水浴锅,上海一恒科学技术有限公司;ZD-9560型脱色摇床,江苏盛蓝仪器制造有限公司;TGL-16M型台式高速冷冻离心机,上海卢湘仪离心机仪器有限公司;JY300HC型电泳仪、JY-SCZ2+型双垂直电泳槽、JY-ZY5型转印电泳槽,北京君意华鑫科技有限公司;ChemiScope Mini 3300型化学发光成像仪,上海勤翔科学仪器有限公司;iS10 型FT-IR spectrometer傅里叶变换红外光谱仪,美国尼高力公司;LC20型高效液相色谱仪、凝胶渗透色谱(gel permeation chromatography,GPC),日本Shimadzu(岛津)公司;UV-6100S型紫外可见分光光度计,上海元析仪器有限公司;0.75 TS型高压细胞破碎仪,英国Constant Systems公司。
1.3 实验方法
1.3.1 植物乳杆菌脂磷壁酸的制备及鉴定
将活化好的植物乳杆菌GSLP-7按质量分数2%的接种量在MRS培养基中连续活化2代,在37 ℃恒温培养箱中培养24 h。用高速冷冻离心机离心去上清液,PBS缓冲液(pH=7.4)清洗菌体3次。参考Morath等[17]的方法,用0.1 mol/L柠檬酸钠缓冲液(pH=4.7)重悬菌体细胞[V(缓冲液)∶V(细胞)=10∶1],置于高压细胞破碎仪中进行破壁[40 kpsi (2.76×108 Pa),2~3次],破碎后的菌体细胞和等体积的水饱和正丁醇溶液混合,充分搅拌30 min,离心收集水相层(4 ℃、13 000 g、30 min)。再用透析袋(3 500 Da)于4 ℃透析,最后冻干得到脂磷壁酸粗提物。然后通过疏水相互作用层析和DEAE-Sepharose离子交换层析的方法[18]纯化脂磷壁酸,将脂磷壁酸粗提物溶解于含有质量分数为15%正丙醇的0.1 mol/L乙酸钠缓冲液(pH=4.7)中,用辛基-琼脂糖凝胶CL-4B凝胶柱(2 cm×20 cm)对脂磷壁酸进行层析,用含线性梯度质量分数为15%~60%正丙醇的0.1 mol/L乙酸钠缓冲液连续梯度洗脱,流速0.5 mL/min,每5 mL收集馏分,检测每个馏分的磷含量。将含有脂磷壁酸的级分进行DEAE-Sepharose离子交换色谱(1.5 cm×20 cm),用含有质量分数30%正丙醇的0.1 mol/L乙酸钠缓冲液(pH=4.7)平衡柱子,用线性盐梯度(0~1 mol/L NaCl水溶液)洗脱,0.5 mL/min,每5 mL收集馏分,检测每个馏分的磷含量。收集脂磷壁酸级分,并透析冷冻干燥得到纯化的脂磷壁酸。
用紫外分光光度法检测纯化的脂磷壁酸在260 nm和280 nm的吸光度值来判断纯度[19-20]。并通过红外光谱和GPC对脂磷壁酸进行鉴定。称取2 mg纯化后的脂磷壁酸样品,加入200 mg干燥溴化钾粉末,混合后研磨压片制样,利用傅里叶变换红外光谱仪测定,波数范围是400~4 000 cm-1,光谱仪分辨率4 cm-1 , 信噪比是50 000∶1,扫描32次;再称取约10 mg样品,溶解于1 mL的水中并混合均匀,用注射器吸取水溶液在0.45 μm的分子膜过滤,微量注射器吸取100 μL滤液,注入GPC测定。
1.3.2 实验动物饲养与分组
将Balb/c小鼠随机分为5组,每组6只。益生菌组,每天灌胃5×1010 CFU/kg植物乳杆菌GSLP-7(以小鼠体质量计);脂磷壁酸组,每天灌胃脂磷壁酸1 mg/kg;阳性药物组,每天灌胃虎地肠溶胶囊0.62 g/kg [剂量的选择是根据人用剂量(1次4粒,1日3次),换算为动物的等效剂量0.4×4×3÷70×9.1=0.62 g/kg],所有药物均用生理盐水溶解后灌胃,健康小鼠组和肠炎小鼠组每天灌胃等体积的生理盐水。第7天灌胃1 h后,除健康小鼠组外,其余实验组小鼠腹腔注射5 mg/kg LPS,诱导肠炎[21-23]。LPS注射12 h后用质量分数为1%戊巴比妥钠麻醉小鼠后,取血液、结肠组织等冷冻保存用于检测分析。
1.3.3 结肠长度及结肠组织病理学观察
小鼠解剖后,取结肠组织,拍摄结肠整体形态照片,用游标卡尺测量结肠长度。并对小鼠结肠进行石蜡切片和HE染色,病理照片由显微摄影系统拍摄,进行组织病理学评分。评分标准见表1,结肠组织学评分=病变范围评分+病变深度评分。
表1 HE切片组织学评分
Tab.1 Histological score of HE section
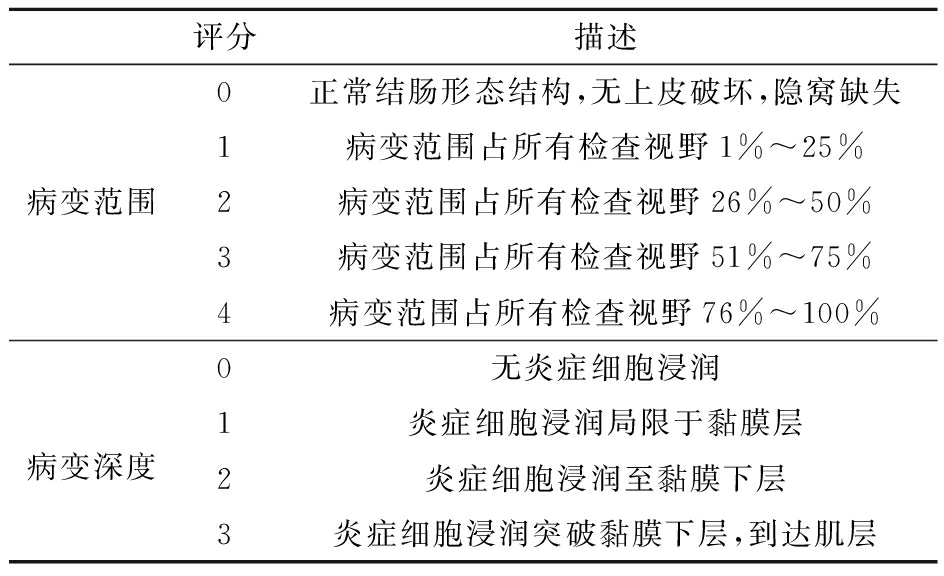
评分描述0正常结肠形态结构,无上皮破坏,隐窝缺失1病变范围占所有检查视野1%~25%病变范围2病变范围占所有检查视野26%~50%3病变范围占所有检查视野51%~75%4病变范围占所有检查视野76%~100%0无炎症细胞浸润病变深度1炎症细胞浸润局限于黏膜层2炎症细胞浸润至黏膜下层3炎症细胞浸润突破黏膜下层,到达肌层
1.3.4 血清中炎症因子的测定
采用摘除眼球法取小鼠全血,室温放置2~4 h,然后离心收集血清保存在-20 ℃冰箱备用。按照ELISA试剂盒操作说明测定小鼠血清中炎症因子TNF-α、IL-6、IL-1β、IL-12、IL-10的含量。
1.3.5 髓过氧化物酶及氧化应激指标的测定
取结肠组织在0.1 mol/L磷酸盐缓冲液(pH=7.4)中制成匀浆。按照MPO检测试剂盒说明书检测小鼠结肠组织和血清中MPO含量。血清中一氧化氮(NO)、丙二醛(MDA)、谷胱甘肽(GSH)和总超氧化物歧化酶(T-SOD)根据试剂盒操作说明进行检测。
1.3.6 粪便中短链脂肪酸的测定
在LPS注射12 h后,脱臼处死小鼠,立即解剖取出肠组织,将盲结肠部位的粪便收集到无菌离心管中。取适量样本加纯水制成匀浆,于4 ℃ 12 000 r/min离心10 min制备血清,再将样品注入配置Agilent HP-INNOWAX毛细管柱(30 m×0.25 mm×0.25 μm)GC-MS中,检测乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸和己酸标准液的浓度,对小鼠粪便中短链脂肪酸的组成和含量进行鉴定。
1.3.7 Western-blot信号通路蛋白表达的测定
将结肠组织样品中加入预冷的裂解液,充分研磨后13 000 r/min,4 ℃离心10 min后取上清液。根据BCA蛋白定量试剂盒测定蛋白浓度,取蛋白样品进行10% SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),再将蛋白转至PVDF膜上,室温封闭30 min,加入一抗:TLR-4(1∶1 000)、MyD88(1∶1 000)、p-ERK(1∶1 000)、NF-κB p65(1∶1 000)、p-NF-κB p65(1∶1 000)、GAPDH(1∶10 000)室温孵育1 h,1×TBST漂洗3次;二抗室温孵育1 h,1×TBST漂洗3次,ECL法显色,用化学发光成像仪成像,使用Quantity one软件对其进行光密度分析,目的蛋白相对表达量=目的蛋白数值/GAPDH数值。
1.4 数据处理
采用IBM SPSS Statistics 26软件进行统计学分析,P<0.05为差异显著;使用Origin 2018 64 Bit软件进行图形绘制。
2 结果与分析
2.1 脂磷壁酸的鉴定及纯度检测结果
为了鉴定纯化后的脂磷壁酸,通过红外光谱和GPC对脂磷壁酸进行分析,结果见图1。由图1(a)可知,提取出的植物乳杆菌GSLP-7脂磷壁酸与脂磷壁酸标品的红外光谱在500~4 000 cm-1处呈现出多种典型的特征性吸收峰高度重合,其中包括—OH基团(3 412 cm-1)、C—H(2 933 cm-1)、C![]() O(1 654 cm-1)、N—H(1 544 cm-1)以及P—O(1 056 cm-1),表征了一个有磷酸甘油结构、酰胺和糖残基的物质。图1(b)中凝胶渗透色谱显示,在保留时间为16.329 min时观察到一个单一的对称峰,脂磷壁酸的分子量为2.22×104 Da,与已报道的脂磷壁酸分子量一致[24]。所以证明提取出的物质为脂磷壁酸。此外,检测到脂磷壁酸OD260 nm=0.026和OD280 nm=0.019,数值极低,可以确定核酸和蛋白质在纯化过程中已被有效去除,说明提取的脂磷壁酸纯度较高,可用于后续实验。
O(1 654 cm-1)、N—H(1 544 cm-1)以及P—O(1 056 cm-1),表征了一个有磷酸甘油结构、酰胺和糖残基的物质。图1(b)中凝胶渗透色谱显示,在保留时间为16.329 min时观察到一个单一的对称峰,脂磷壁酸的分子量为2.22×104 Da,与已报道的脂磷壁酸分子量一致[24]。所以证明提取出的物质为脂磷壁酸。此外,检测到脂磷壁酸OD260 nm=0.026和OD280 nm=0.019,数值极低,可以确定核酸和蛋白质在纯化过程中已被有效去除,说明提取的脂磷壁酸纯度较高,可用于后续实验。
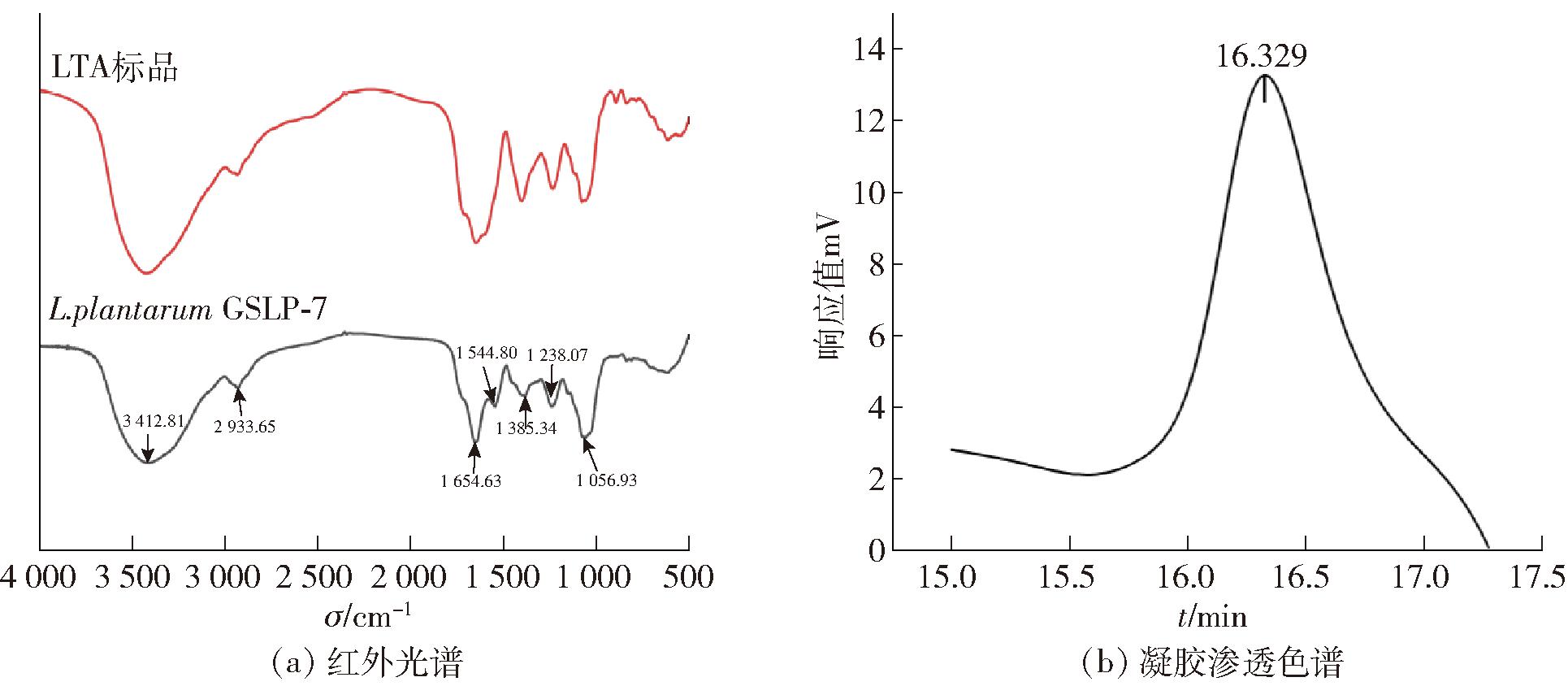
图1 脂磷壁酸红外光谱和凝胶渗透色谱分析
Fig.1 Infrared spectroscopy and gel permeation chromatography analysis of LTA
2.2 脂磷壁酸对小鼠结肠组织的影响
为了明确植物乳杆菌脂磷壁酸对小鼠肠炎的缓解作用,研究将30只Balb/c雄性小鼠随机分为5组,每天分别灌胃生理盐水(健康小鼠组、肠炎小鼠组),5×1010 CFU/kg植物乳杆菌GSLP-7(益生菌组),1 mg/kg脂磷壁酸(脂磷壁酸组),0.62 g/kg虎地肠溶胶囊(阳性药物组),灌胃第7天结束后除健康小鼠外,其余4组腹腔注射5 mg/kg LPS诱导炎症,12 h后采集小鼠组织和血液等样本进行检测。在实验期间,除空白组外的小鼠在LPS诱导后均出现体重减轻,伴随精神萎靡及粪便潜血等症状,说明造模成功。需要说明的是,实验所用的脂磷壁酸来自植物乳杆菌GSLP-7,制备1 mg脂磷壁酸需要5×1010 CFU植物乳杆菌菌体,这样在脂磷壁酸含量相同的情况下,可以更好地与“益生菌组”的数据进行比较。小鼠结肠长度与组织病理学分析结果见图2。
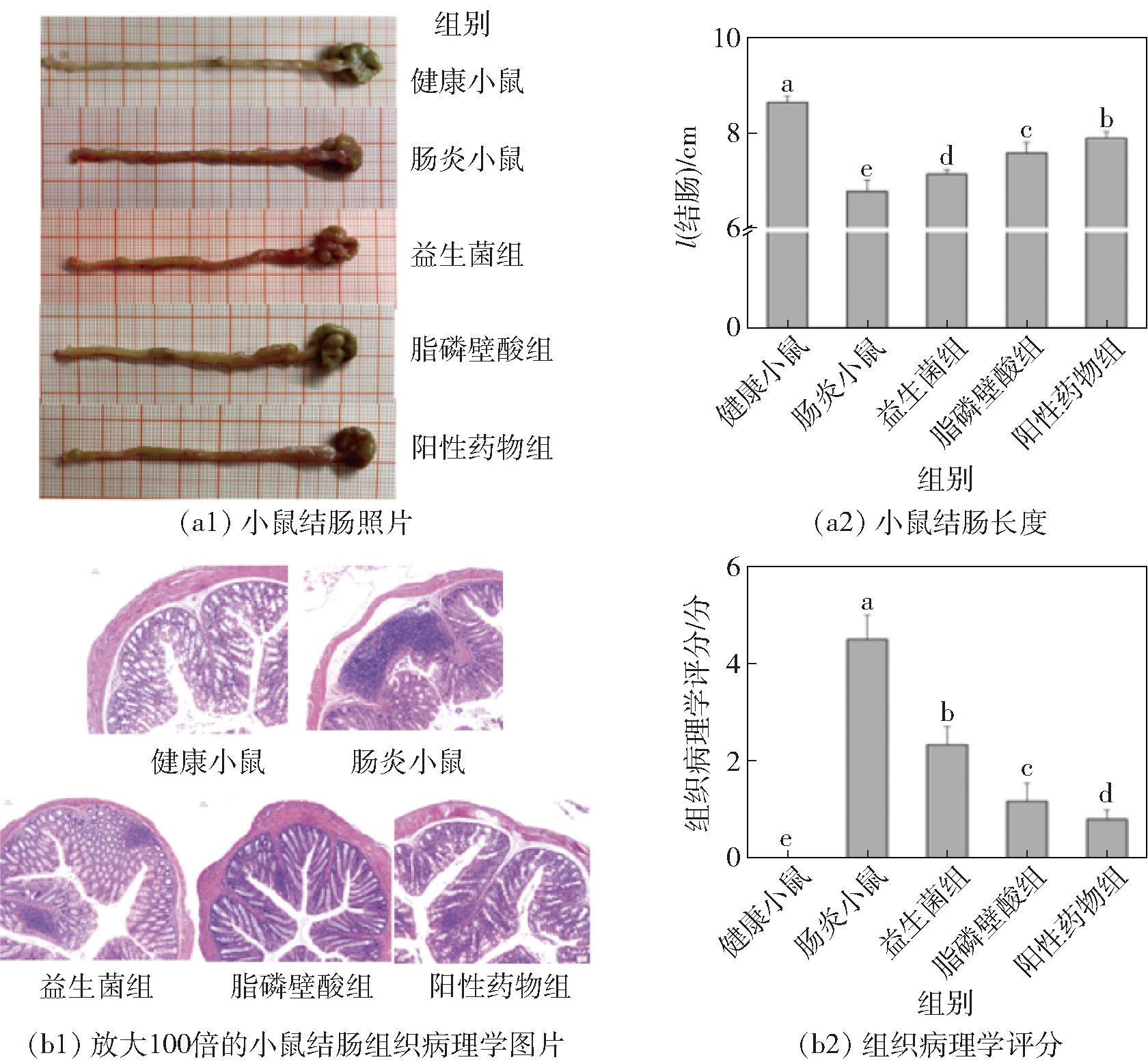
不同字母表示组间差异显著(P<0.05)。
图2 小鼠结肠长度与组织病理学分析
Fig.2 Colon length and histopathological analysis of mice
首先截取小鼠结肠,检测和比较各组小鼠结肠长度和结肠组织损伤程度的差异,由图2(a)可见,与健康小鼠相比,肠炎小鼠结肠长度显著缩短21.66%(P<0.05),采用益生菌、脂磷壁酸和药物处理后小鼠的结肠萎缩减轻,萎缩的程度由大到小依次为益生菌组(17.55%)、脂磷壁酸组(12.38%)、阳性药物组(8.71%)。由图2(b)可以观察到健康小鼠结肠结构完整,细胞排列整齐;而肠炎小鼠结肠组织病理学评分显著升高,结肠结构受损严重,黏膜下层有出血、水肿并伴随大量中性粒细胞和淋巴细胞浸润及上皮细胞脱落,表明肠炎造模成功;给予益生菌、脂磷壁酸以及虎地肠溶胶囊的小鼠,结肠黏膜结构破损减轻,炎症浸润程度有所缓解,组织病理学评分由高到低依次为益生菌组(2.80分)、脂磷壁酸组(1.80分)、阳性药物组(1.00分),组织病理学评分结果与结肠长度损伤结果一致。上述结肠组织的检测结果表明,脂磷壁酸能够缓解LPS造成的小鼠结肠组织损伤,效果优于植物乳杆菌(P<0.05)。
2.3 脂磷壁酸对小鼠血清中细胞因子水平的影响
肠道炎症的发生会伴随免疫的失调[25],检测了各组小鼠血清中细胞因子含量的变化,结果见图3。由图3可知,与健康小鼠相比,肠炎小鼠血清中的促炎因子TNF-α、IL-1β、IL-6及IL-12的含量均显著增加,抗炎因子IL-10的含量显著下降(P<0.05),出现了明显的细胞因子水平异常。脂磷壁酸干预后,血清中促炎因子TNF-α、IL-1β、IL-6及IL-12含量比肠炎小鼠分别降低了34.97%、52.47%、38.59%、34.30%,抗炎因子IL-10含量提高了24.78%,优于益生菌组的改善水平23.28%、37.80%、16.29%、24.07%和6.23%(P<0.05)。与阳性药物组相比,脂磷壁酸组对细胞因子TNF-α、IL-1β和IL-10水平的影响两组无显著差异(P>0.05),对IL-6的改善作用强于药物,对IL-12的改善作用弱于药物(P<0.05)。结果表明,脂磷壁酸、益生菌和阳性药物均能显著改善肠炎小鼠的细胞因子失调,其中脂磷壁酸的改善效果优于益生菌,整体上与阳性药物的改善水平相近,表现出了较强的细胞因子调节能力。
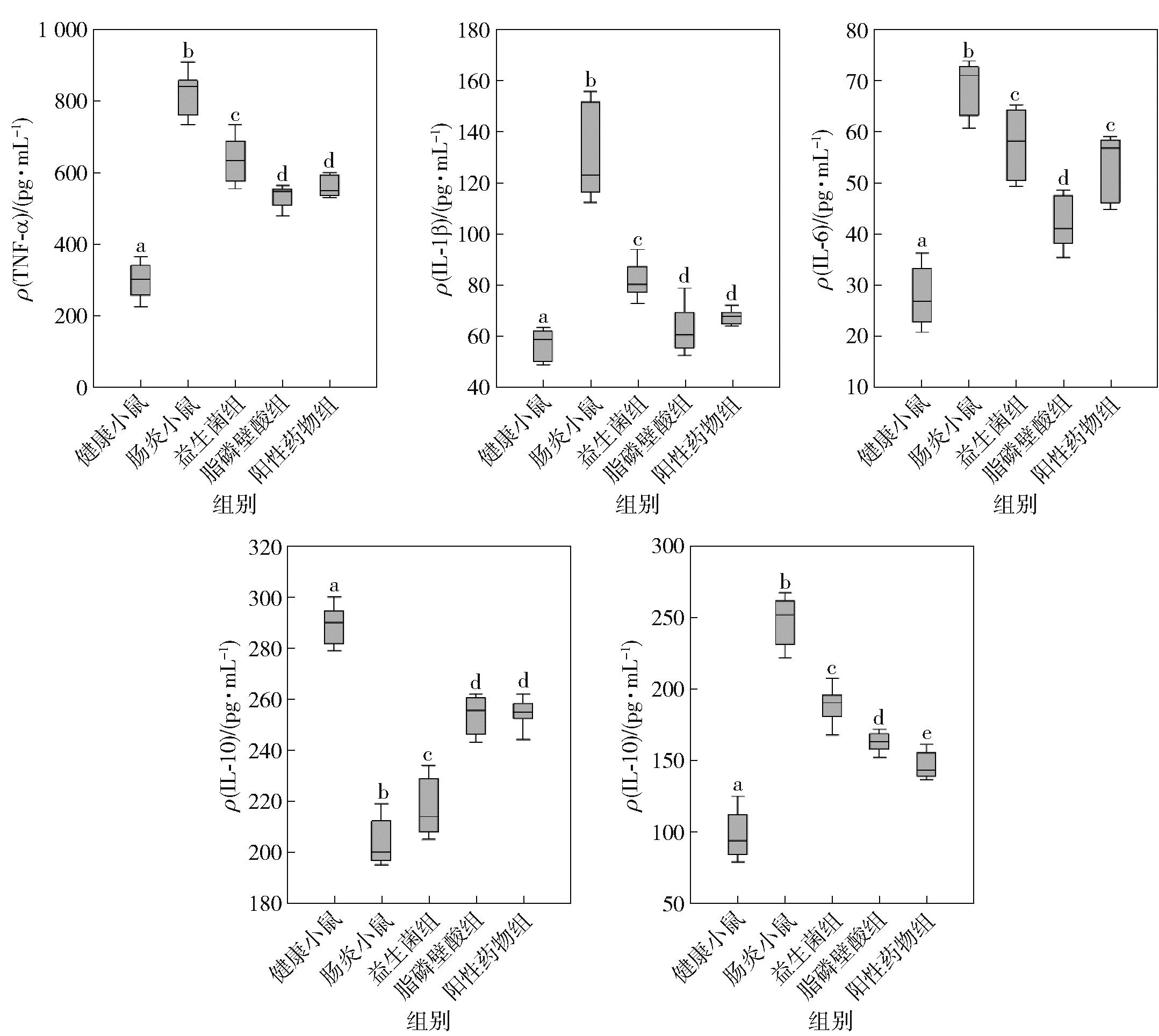
不同字母表示组间差异显著(P<0.05)。
图3 小鼠血清中炎症因子变化
Fig.3 Changes of cytokines profile in mouse serum
2.4 脂磷壁酸对小鼠氧化应激的影响
炎症性肠病的氧化应激指的是在病理状态中,肠道屏障受损后有害物刺激机体,导致机体内外的活性氧增加,氧化还原系统失衡,诱发应激反应,它是判断炎症性肠病发展情况的指标之一[26]。检测了各组小鼠的多个氧化应激指标,包括MPO活性、血清中一氧化氮(NO)、丙二醛(MDA)、谷胱甘肽(GSH)和总超氧化物歧化酶(T-SOD)的含量。结果见图4。由图4可知,与健康小鼠相比肠炎小鼠结肠组织中的MPO活性及血清中的MPO、NO、MDA活性和含量均显著增加(P<0.05),GSH和SOD的活性显著降低(P<0.05),表明小鼠体液的氧化还原系统失衡,处于氧化应激状态。益生菌、脂磷壁酸和阳性药物干预的小鼠各项指标改善显著(P<0.05),3个组的氧化相关指标(MPO、NO和MDA)的改善程度由大到小依次为阳性药物组、脂磷壁酸组、益生菌组(P<0.05),对于抗氧化相关指标(GSH和T-SOD)3个组间无显著差异(P>0.05)。脂磷壁酸组相比肠炎小鼠的结肠组织MPO及血清MPO、NO、MDA分别降低了27.93%、23.84%、29.60%、35.32%,血清T-SOD和GSH分别增加了56.86%和39.74%(P<0.05)。本研究结果表明,脂磷壁酸能够显著降低肠炎小鼠的氧化应激水平,降低机体的氧化损伤程度,缓解炎症症状,这与组织切片观察到的结果和细胞因子的检测结果一致。
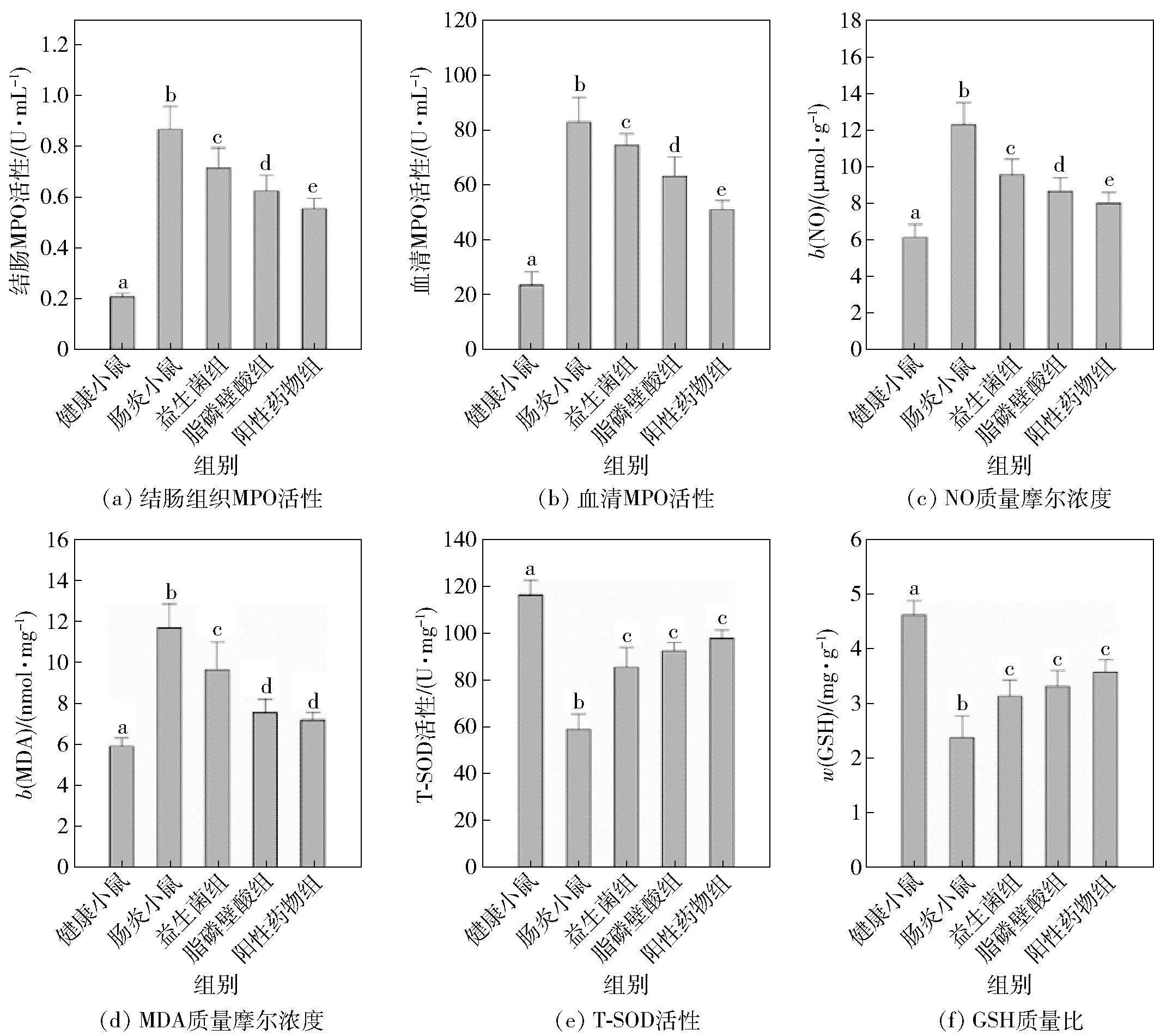
不同字母表示组间差异显著(P<0.05)。
图4 小鼠的氧化应激指标变化
Fig.4 Changes of oxidative stress indicators of mice
2.5 脂磷壁酸对肠炎小鼠肠道中短链脂肪酸的影响
短链脂肪酸是肠道内环境健康情况的指标之一,它们通过抑制病原菌生长、参与肠上皮细胞的信号转导,影响细胞的生长、能量代谢和调节免疫,维持肠道内环境的生态平衡[27]。为了明确脂磷壁酸干预下肠炎小鼠肠道内环境的变化,我们采集小鼠盲结肠的粪便,检测了其中乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、己酸和短链脂肪酸总量的变化,并与健康小鼠、肠炎小鼠和益生菌与药物干预的小鼠进行了对比分析,结果见表2。由表2可知,与健康小鼠相比,肠炎小鼠粪便中检测的所有短链脂肪酸均出现了显著的下降(P<0.05),短链脂肪酸总量为健康小鼠的16.41%,而益生菌、脂磷壁酸以及阳性药物干预小鼠的SCFA总量比肠炎小鼠提高了4.27倍、3.92倍和3.91倍,其中脂磷壁酸组与阳性药物组间统计学差异不显著(P>0.05)。从各类短链脂肪酸的变化量看,益生菌干预对丙酸的影响最大,干预后的丙酸质量比(611.49 μg/g)恢复至健康小鼠水平(628.94 μg/g),二者无统计学差异(P>0.05)。脂磷壁酸对己酸的含量影响最大,为肠炎组的3.23倍(P<0.05),脂磷壁酸对其他种类短链脂肪酸的影响与益生菌或阳性药物基本相近,大多无显著差异(P>0.05)。本研究结果表明,益生菌、脂磷壁酸和阳性药物均能够增加肠炎小鼠肠道中SCFA的含量,修复小鼠肠道的内环境,益生菌略强于脂磷壁酸和阳性药物。
表2 小鼠粪便中短链脂肪酸的含量
Tab. 2 Content of short-chain fatty acids in mice feces μg/g
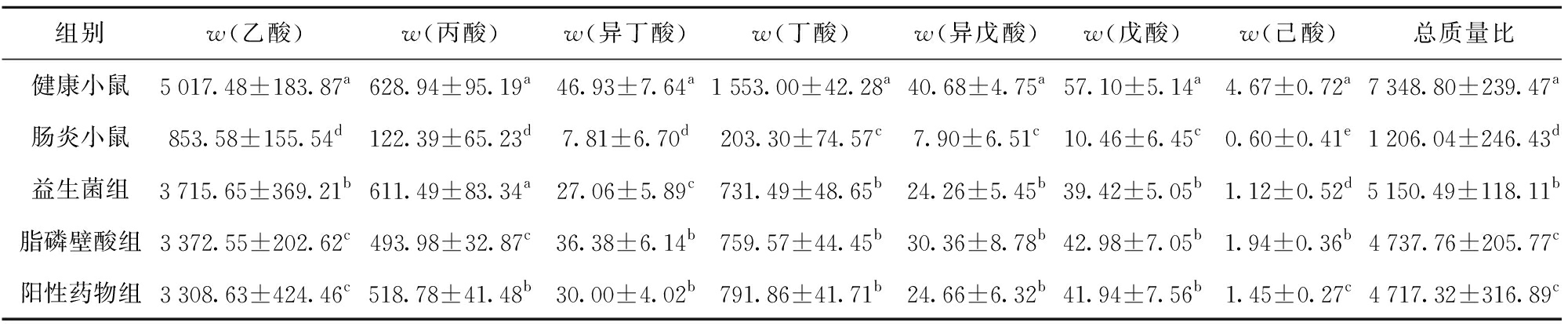
组别w(乙酸)w(丙酸)w(异丁酸)w(丁酸)w(异戊酸)w(戊酸)w(己酸)总质量比健康小鼠5017.48±183.87a628.94±95.19a46.93±7.64a1553.00±42.28a40.68±4.75a57.10±5.14a4.67±0.72a7348.80±239.47a肠炎小鼠853.58±155.54d122.39±65.23d7.81±6.70d203.30±74.57c7.90±6.51c10.46±6.45c0.60±0.41e1206.04±246.43d益生菌组3715.65±369.21b611.49±83.34a27.06±5.89c731.49±48.65b24.26±5.45b39.42±5.05b1.12±0.52d5150.49±118.11b脂磷壁酸组3372.55±202.62c493.98±32.87c36.38±6.14b759.57±44.45b30.36±8.78b42.98±7.05b1.94±0.36b4737.76±205.77c阳性药物组3308.63±424.46c518.78±41.48b30.00±4.02b791.86±41.71b24.66±6.32b41.94±7.56b1.45±0.27c4717.32±316.89c
不同字母表示同列数据差异显著(P<0.05)。
2.6 脂磷壁酸对小鼠肠道信号通路蛋白的影响
为了进一步研究脂磷壁酸缓解肠道炎症的机制,研究采用Western-blot方法检测了结肠细胞中,与LPS诱导的炎症性肠病相关的TLR4-MyD88-MAPK信号通路和NF-κB信号通路蛋白表达量的变化,结果见图5。由图5(a)可知,与健康小鼠相比,肠炎小鼠的MyD88、TLR-4、p-ERK蛋白水平显著升高,说明LPS诱导后激活了TLR4-MyD88-MAPK信号通路,这与Zamyatina等[28]的报道一致。相比肠炎小鼠,益生菌、脂磷壁酸和药物干预的小鼠MyD88、TLR-4、p-ERK蛋白的表达量均显著下降(P<0.05),但3个干预组间差异不显著(P>0.05)。脂磷壁酸组MyD88、TLR-4、p-ERK蛋白的表达量相比肠炎小鼠分别降低了15.79%、42.53%、35.16%,其中脂磷壁酸对LPS受体TLR-4的影响是接头分子MyD88的3倍左右,这一结果支持脂磷壁酸占位阻遏LPS的猜测:脂磷壁酸阻碍了LPS与TLR-4受体的结合,但自身与表面受体的结合产生的信号仍会调动接头分子MyD88[29]。类似地,由图5(b)可知,与健康小鼠相比,肠炎小鼠的NF-κB p65和p-NF-κB p65蛋白水平显著升高(P<0.05);脂磷壁酸组小鼠的NF-κB p65和p-NF-κB p65蛋白水平比肠炎小鼠分别降低了39.02%、63.19%(P<0.05);且相比于益生菌组和阳性药物组,脂磷壁酸的下调作用更显著。本研究结果表明,脂磷壁酸干预改变了TLR4-MyD88-MAPK信号通路和NF-κB信号通路的蛋白表达,阻遏了炎症信号通路。
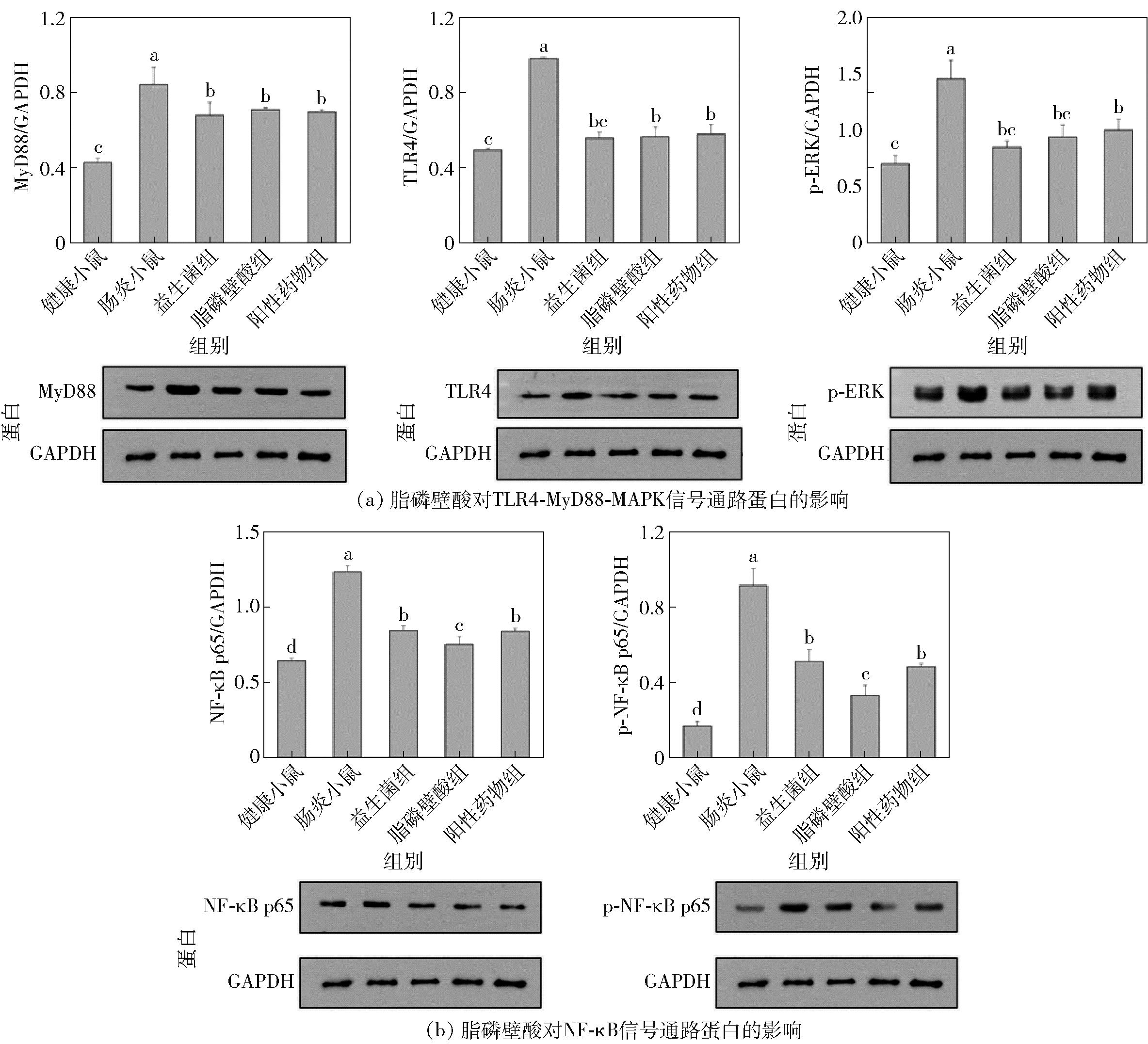
不同小写字母表示组间差异显著(P<0.05)。
图5 脂磷壁酸对小鼠肠道信号通路蛋白的影响
Fig.5 Effects of lipoteichoic acid on intestinal signaling pathway proteins in mice
3 讨 论
脂磷壁酸作为一种新的潜在的抗肠炎的功能因子[30-31],对其了解还比较少。研究采用益生菌及其脂磷壁酸对比研究的方式,探究脂磷壁酸对肠炎的缓解作用,为抗肠炎功能因子的研究提供了一个较好的思路。
研究中植物乳杆菌脂磷壁酸对细胞因子TNF-α、IL-6的调节作用均强于菌株本身,且对IL-6的调节作用超过了阳性药物虎地肠溶胶囊。这两种细胞因子是IBD病理过程中的关键细胞因子,与肠炎的严重程度正相关[32-33],表明脂磷壁酸对肠炎的治疗作用强于益生菌本身。在氧化应激反应的研究中,出现了相似的现象:益生菌及其脂磷壁酸都能够降低肠炎小鼠的氧化应激指标(MPO、MDA、NO),且脂磷壁酸对这几个指标的作用都显著强于菌体。从脂磷壁酸的角度分析,研究所采用的脂磷壁酸灌胃剂量与灌胃的益生菌携带的脂磷壁酸含量是一致的,因此产生这种差异的原因可能与脂磷壁酸在菌体和分离后的存在形式有关。菌体中脂磷壁酸结合在细胞壁上,不易释放;制备的脂磷壁酸分子尺寸更小,与肠上皮细胞接触机会更多,抗原活性更强,可以产生更好的免疫调节活性[34]。
脂磷壁酸较强的抗炎和抗氧化损伤能力也表现在了它对结肠组织和肠道内环境的保护修复作用上[35-36]。如灌胃脂磷壁酸后小鼠结肠萎缩减轻、肠上皮细胞浸润减少、肠壁屏障完整性增强。脂磷壁酸不能像菌体一样通过直接调节肠道微生态来增加短链脂肪酸的含量,但脂磷壁酸通过修复肠道屏障改善了肠道内环境,所以仍然观察到了脂磷壁酸显著地提高了肠道内短链脂肪酸的含量。
关于脂磷壁酸的抗肠炎的分子机制,多数报道认为,脂磷壁酸通过激活机体免疫,同时通过阻遏LPS与TLR4受体的结合,降低促炎反应[37]。例如LPS诱导的肠炎主要通过与TLR4结合促进下游TRIF和MyD88依赖性NF-κB等途径的激活,产生炎症反应[38],而激活TLR2受体、抑制NF-κB途径可以促进细胞存活,维持肠上皮屏障的完整性[39],降低炎症反应。研究中脂磷壁酸显著下调了炎性RAW 264.7巨噬细胞中MyD88、TLR-4、p-ERK、NF-κB p65和p-NF-κB p65蛋白水平,阻断了TLR4-MyD88-MAPK及NF-κB信号通路。
4 结 论
植物乳杆菌脂磷壁酸通过调节肠炎小鼠TNF-α、IL-1β、IL-6、IL-10、IL-12炎症细胞因子的水平,降低了肠上皮细胞TLR4,MyD88和MAPK关键蛋白的表达,阻断了TLR4-MyD88-MAPK和NF-κB信号通路,减轻了肠炎小鼠的结肠组织病理学损伤,提高了肠道屏障的完整度和肠道短链脂肪酸含量。植物乳杆菌脂磷壁酸同时改善了肠炎小鼠肠道的氧化应激,结肠组织和血清中的MPO活性降低,T-SOD和GSH活性增加。植物乳杆菌脂磷壁酸具有良好的缓解肠炎的作用,具备潜在的功能性食品和药品应用研究价值。
[1] ZUO T, KAMM M A, COLOMBEL J F, et al. Urbanization and the gut microbiota in health and inflammatory bowel disease[J]. Nature Reviews Gastroenterology &Hepatology, 2018, 15(7): 440-452.
[2] 傅晨晨. 成人炎症性肠病患者家庭肠内营养管理方案的构建[D]. 蚌埠: 蚌埠医学院, 2022.FU C C. Construction of family enteral nutrition management scheme for adult patients with inflammatory bowel disease[D]. Bengbu: Bengbu Medical College, 2022.
[3] 关曼缇, 张英春, 卢卫红, 等. 乳酸杆菌脂磷壁酸的结构及免疫调控功能研究进展[J]. 食品科学, 2021, 42(21): 278-284.GUAN M T, ZHANG Y C, LU W H, et al. Progress in research on the structure and immune-regulating effect of Lactobacillus lipoteichoic acid[J]. Food Science, 2021, 42(21): 278-284.
[4] 励建荣, 檀茜倩, 王丹, 等. 基于益生菌及其代谢物的食源性致病微生物控制技术研究进展[J]. 食品科学技术学报, 2022, 40(3):1-12.LI J R, TAN X Q, WANG D, et al. Recent approaches in probiotics and their metabolites research to control foodborne pathogens[J]. Journal of Food Science and Technology, 2022, 40(3):1-12.
[5] KIM Y, PARK J Y, KIM H, et al. Differential role of lipoteichoic acids isolated from Staphylococcus aureus and Lactobacillus plantarum on the aggravation and alleviation of atopic dermatitis[J]. Microbial Pathogenesis, 2020, 147: 104360.
[6] LU Q Q, GUO Y Q, YANG G, et al. Structure and anti-inflammation potential of lipoteichoic acids isolated from Lactobacillus strains[J]. Foods, 2022, 11(11): 1610.
[7] KIM H G, LEE S Y, KIM N R, et al. Lactobacillus plantarum lipoteichoic acid down-regulated Shigella flexneri peptidoglycan-induced inflammation[J]. Molecular Immunology, 2011, 48(4): 382-391.
[8] WANG S H, AHMADI S, NAGPAL R, et al. Lipoteichoic acid from the cell wall of a heat killed Lactobacillus paracasei D3-5 ameliorates aging-related leaky gut, inflammation and improves physical and cognitive functions: from C. elegans to mice[J]. GeroScience, 2020, 42(1): 333-352.
[9] 周超, 王璞, 黄燚, 等. 乳酸杆菌脂磷壁酸抑制脂多糖诱导的大鼠肝脏Kupffer细胞TLR4通路的激活[J]. 现代生物医学进展, 2015, 15(21): 4009-4013.ZHOU C, WANG P, HUANG Y, et al. Lipoteichoic acid of Lactobacillus bulgaricus inhibits the lipopolysaccharide-activated TLR4 pathway in rat kupffer cells[J]. Progress in Modern Biomedicine, 2015, 15(21): 4009-4013.
[10] GAO J J, XUE Q, ZUVANICH E G, et al. Commercial preparations of lipoteichoic acid contain endotoxin that contributes to activation of mouse macrophages in vitro[J]. Infection and Immunity, 2001, 69(2): 751-757.
[11] ARIMA H, MOTOYAMA K, MATSUKAWA A, et al. Inhibitory effects of dimethylacetyl-beta-cyclodextrin on lipopolysaccharide-induced macrophage activation and endotoxin shock in mice[J]. Biochemical Pharmaco-logy, 2005, 70(10): 1506-1517.
[12] ENGLISH B K, PATRICK C C, ORLICEK S L, et al. Lipoteichoic acid from viridans streptococci induces the production of tumor necrosis factor and nitric oxide by murine macrophages[J]. Journal of Infectious Diseases, 1996, 174(6): 1348-1351.
[13] KIM A R, KANG M J, YOO Y J, et al.Lactobacillus plantarum lipoteichoic acid disrupts mature Enterococcus faecalis biofilm[J]. Journal of Microbiology, 2020, 58(4): 314-319.
[14] JIANG Y Y, YANG Z N. A functional and genetic overview of exopolysaccharides produced by Lactobacillus plantarum[J]. Journal of Functional Foods, 2018, 47: 229-240.
[15] LIU J Y, CHEN N, ZHANG Z T, et al. Screening and evaluation of prebiotic exopolysaccharide of Lactobacillus plantarum on treating IBD in mice[J]. Food Biosciece, 2024, 59:104098.
[16] ZHANG J, CAI D Y, YANG M, et al. Screening of folate-producing lactic acid bacteria and modulatory effects of folate-biofortified yogurt on gut dysbacteriosis of folate-deficient rats[J]. Food &Function, 2020, 11(7): 6308-6318.
[17] MORATH S, GEYER A, HARTUNG T. Structure-function relationship of cytokine induction by lipoteichoic acid from Staphylococcus aureus[J]. Journal of Experimental Medicine, 2001, 193(3): 393-397.
[18] R IS
IS NEN L, SCHUBERT K, JAAKONSAARI T, et al. Characterization of lipoteichoic acids as Lactobacillus delbrueckii phage receptor components[J]. Journal of Bacteriology, 2004, 186(16): 5529-5532.
NEN L, SCHUBERT K, JAAKONSAARI T, et al. Characterization of lipoteichoic acids as Lactobacillus delbrueckii phage receptor components[J]. Journal of Bacteriology, 2004, 186(16): 5529-5532.
[19] KIM H G, LEE S Y, KIM N R, et al. Inhibitory effects of Lactobacillus plantarum lipoteichoic acid (LTA) on Staphylococcus aureus LTA-induced tumor necrosis factor-alpha production[J]. Journal of Microbiology and Biotechnology, 2008, 18(6): 1191-1196.
[20] VIDAL K, DONNET-HUGHES A, GRANATO D. Lipoteichoic acids from Lactobacillus johnsonii strain La1 and Lactobacillus acidophilus strain La10 antagonize the responsiveness of human intestinal epithelial HT29 cells to lipopolysaccharide and gram-negative bacteria[J]. Infection and Immunity, 2002, 70(4): 2057-2064.
[21] FAN L L, YAO Q Q, WU H M, et al. Protective effects of recombinant lactoferrin with different iron saturations on enteritis injury in young mice[J]. Journal of Dairy Science, 2022, 105(6): 4791-4803.
[22] RUAN D, WU S W, FOUAD A M, et al. Curcumin alleviates LPS-induced intestinal homeostatic imbalance through reshaping gut microbiota structure and regulating group 3 innate lymphoid cells in chickens[J]. Food &Function, 2022, 13(22): 11811-11824.
[23] ZHANG J F, YANG Y X, HAN H L, et al. Bisdemethoxycurcumin attenuates lipopolysaccharide-induced intestinal damage through improving barrier integrity, suppressing inflammation, and modulating gut microbiota in broilers[J]. Journal of Animal Science, 2021, 99(11): skab296.
[24] 刘琨, 侯本祥. 微小小单胞菌ATCC33270脂磷壁酸致炎作用的研究[J]. 北京口腔医学, 2020, 28(4): 208-212.LIU K, HOU B X. The inflammation induced by Parvimonas micra ATCC33270 lipoteichoic acid[J]. Beijing Journal of Stomatology, 2020, 28(4): 208-212.
[25] 陈洋. 产共轭亚油酸双歧杆菌对结肠炎的缓解作用及机制研究[D]. 无锡: 江南大学, 2021.CHEN Y. Study on the relieving effect and mechanism of Bifidobacterium producing conjugated linoleic acid on colitis[D]. Wuxi: Jiangnan University, 2021.
[26] 李杰, 谢海玲, 李昭辉, 等. 氧化应激在炎症性肠病和结肠炎相关结直肠癌疾病中的研究进展[J]. 胃肠病学和肝病学杂志, 2022, 31(7): 836-840.LI J, XIE H L, LI Z H, et al. Research progress of oxidative stress in inflammatory bowel disease and colitis related colorectal cancer[J]. Chinese Journal of Gastroenterology and Hepatology, 2022, 31(7): 836-840.
[27] IKEDA T, NISHIDA A, YAMANO M, et al. Short-chain fatty acid receptors and gut microbiota as therapeutic targets in metabolic, immune, and neurological diseases[J]. Pharmacology &Therapeutics, 2022, 239: 108273.
[28] ZAMYATINA A, HEINE H. Lipopolysaccharide recognition in the crossroads of TLR4 and caspase-4/11 mediated inflammatory pathways[J]. Frontiers in Immunology, 2020, 11: 585146.
[29] WATANABE S, ZENKE K, MUROI M. Lipoteichoic acid inhibits lipopolysaccharide-induced TLR4 signaling by forming an inactive TLR4/MD-2 complex dimer[J]. Journal of Immunology, 2023, 210(9): 1386-1395.
[30] LEBEER S, CLAES I J J, VANDERLEYDEN J. Anti-inflammatory potential of probiotics: lipoteichoic acid makes a difference[J]. Trends in Microbiology, 2012, 20(1): 5-10.
[31] HUANG B R, TSAI C F, LIN H Y, et al. Interaction of inflammatory and anti-inflammatory responses in microglia by Staphylococcus aureus-derived lipoteichoic acid[J]. Toxicology and Applied Pharmacology, 2013, 269(1): 43-50.
[32] JU S W, GE Y, LI P, et al. Dietary quercetin ameliorates experimental colitis in mouse by remodeling the function of colonic macrophages via a heme oxygenase-1-dependent pathway[J]. Cell Cycle, 2018, 17(1): 53-63.
[33] YE M, JOOSSE M E, LIU L, et al. Deletion of IL-6 exacerbates colitis and induces systemic inflammation in IL-10-deficient mice[J]. Journal of Crohn’s and Colitis, 2020, 14(6): 831-840.
[34] HONG S W, BAIK J E, KANG S S, et al. Lipoteichoic acid of Streptococcus mutans interacts with Toll-like receptor 2 through the lipid moiety for induction of inflammatory mediators in murine macrophages[J]. Molecular Immunology, 2014, 57(2): 284-291.
[35] MOHAMADZADEH M, PFEILER E A, BROWN J B, et al. Regulation of induced colonic inflammation by Lactobacillus acidophilus deficient in lipoteichoic acid[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(S1): 4623-4630.
[36] KIM H, JUNG B J, JUNG J H, et al. Lactobacillus plantarum lipoteichoic acid alleviates TNF-α-induced inflammation in the HT-29 intestinal epithelial cell line[J]. Molecules and Cells, 2012, 33(5): 479-486.
[37] CHANDLER C E, ERNST R K. Bacterial lipids: powerful modifiers of the innate immune response[J]. F1000Research, 2017, 6: 1334.
[38] XIONG T X, ZHENG X, ZHANG K, et al. Ganluyin ameliorates DSS-induced ulcerative colitis by inhibiting the enteric-origin LPS/TLR4/NF-κB pathway[J]. Journal of Ethnopharmacology, 2022, 289: 115001.
[39] SHI M X, YUE Y S, MA C, et al. Pasteurized Akkermansia muciniphila ameliorate the LPS-induced intestinal barrier dysfunction via modulating AMPK and NF-κB through TLR2 in Caco-2 cells[J]. Nutrients, 2022, 14(4): 764.