欧薄荷(Mentha longifolia L.)是唇形科(Labiatae)薄荷属(Mentha)多年生草本植物,喜欢在温暖潮湿的地方生长,多生长在河沟边或山野潮湿地,起源于欧洲,目前在我国除西藏外各省均有分布。欧薄荷是一种重要的药食同源的植物,作为食物,欧薄荷有着悠久的使用历史,其嫩叶不仅可以直接作为菜品食用,还可以在烹饪时作为调味香料,亦或是作为代茶泡水[1]。欧薄荷药用时具有散气、发汗、消炎、安神等功能[2]。此外,欧薄荷精油在抗氧化、抑菌[3-4]、止腹泻[5]和肝保护[6]等方面也有很好的生物活性。
欧薄荷含有的薄荷油,是欧薄荷具有多种药理作用的原因之一。作为精油制备的第一步,干燥方法是影响精油产率、组成成分和生物活性的主要因素之一[7]。Rodrigo等[8]研究了不同干燥方法对苦橙皮精油产率、化学组成成分及抗氧化和抑菌活性的影响,发现冷冻干燥是保持苦橙皮精油生物活性最有效的干燥方法。康显杰等[9]研究了晒干、鼓风干燥和微波干燥对片姜黄精油的影响,发现鼓风干燥和微波干燥,可能会使其精油成分中的莪术二酮和新莪术二酮发生异构化反应,使其相对含量发生变化。Guo等[7]研究了不同干燥方法对孜然籽精油化学成分和生物活性的影响,发现干燥方法使孜然籽精油在得率、化学成分、抗氧化和抑菌活性以及细菌DNA损伤保护作用方面均有差异。可见,选择合适的干燥方法对精油的质量有着重要影响。
先后有季节、生长环境及不同提取方法对欧薄荷精油成分差异影响的研究[10-13]。但有关干燥方法的研究较少,本研究以阴干、晒干、40 ℃烘干等3种不同方法对新疆阿克苏地区生长期野生欧薄荷地上部分进行干燥处理,以新鲜欧薄荷为对比,用水蒸气蒸馏法提取精油,研究了干燥方法对欧薄荷精油产率的影响。通过气相色谱- 四极杆- 飞行时间质谱联用仪(gas chromatography-quadrupole-time-of-flight mass spectrometry,GC-Q-TOF/MS)定性分析精油化学成分,气相色谱- 氢火焰离子检测器(gas chromatography-flame ionization detection,GC-FID)分析各成分相对含量,研究了干燥方法对精油化学成分及含量的影响。并通过DPPH自由基清除实验及ABTS阳离子自由基清除实验研究了干燥方法对欧薄荷精油抗氧化活性的影响,并用纸片扩散法研究了干燥方法对精油抑菌活性的影响。
1 材料与方法
1.1 材料与试剂
欧薄荷采摘于新疆阿克苏地区库车县,经中国科学院新疆理化技术研究所鲁春芳副研究员鉴别为唇形科(Labiatae)薄荷属(Mentha)欧薄荷(Mentha longifolia L.),标本编号为:WY02663,引证标本存放于中国科学院新疆理化技术研究所。正己烷,分析纯,天津益力化学试剂有限公司;水解酪蛋白胨琼脂(MHA)、水解酪蛋白胨肉汤(MHB)、沙氏葡萄糖琼脂(SDA)、沙氏葡萄糖液体培养基(SDB),青岛海博生物技术有限公司。
2,2-联苯基-1-苦基肼基(DPPH自由基),2,2-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS阳离子自由基),过硫酸钾,正构烷烃(C7~C40),Sigma-Aldrich公司; DMSO,天津永晟精细化工有限公司;无水硫酸钠,合肥巴斯夫生物科技有限公司;药敏纸片(直径6 mm),杭州微生物公司;白色念珠菌(Candida Albicans;ATCC 10231)、大肠杆菌(Escherichia coli;ATCC 11229)、金黄色葡萄球菌(Staphylococcus aureus;ATCC 6538)标准菌株,购自广东环凯微生物科技有限公司。
1.2 仪器与设备
7890B型气相色谱- 四极杆- 飞行时间质谱联用仪(GC-Q-TOF/MS)[配有电子轰击离子源(EI)及Qualitative Analysis B.07.00数据处理系统],美国安捷伦公司;7890B型气相色谱系统 (配有氢火焰离子检测器和Agilent Open LAB control panel色谱工作站),美国安捷伦公司;Bio-Rad 550型酶标仪,伯乐生命医学产品(上海)有限公司;细菌浊度仪,杭州齐威仪器有限公司。
1.3 实验方法
1.3.1 欧薄荷干燥方法
新采摘的欧薄荷地上部分分别采用阴干、晒干和40 ℃烘干等3种方法干燥。
阴干方法是将新鲜欧薄荷晾在自然通风和无阳光直射的房间[(21±6)℃],持续干燥14 d。晒干方法是将新鲜欧薄荷平铺在无遮挡物,阳光可直射的地面上,持续干燥两天(气温:20~28 ℃,北风3至4级)。烘干方法是将样品在烘箱(径体尺寸为55 cm×45 cm×55 cm)的托盘上单层铺开,干燥温度为40 ℃,持续干燥8 h。
1.3.2 欧薄荷精油提取方法
参照Sousa等[14]的提取方法稍做修改,准确称量新鲜、阴干、晒干、欧薄荷、烘干欧薄荷4种样品各100 g,隔水蒸馏提取4 h,收集精油并用无水硫酸钠干燥,4 ℃保存。每组实验重复3次,精油产率按式(1)计算。
精油产率![]()
(1)
式(1)中,m1为精油质量,g;m2为样品质量,g。
1.3.3 GC-FID分析方法
将50 μL精油溶解于1.45 mL正己烷中,进行GC-FID检测。
色谱柱为HP-5石英毛细柱(30 m×0.32 mm×0.25 μm)。升温程序为60 ℃保持5 min,以4 ℃/min升至280 ℃,保持2 min。载气为氮气,流速1.0 mL/min。进样量0.3 μL,分流比为30∶1。使用峰面积归一化法进行精油中各成分相对含量的计算。
1.3.4 GC-Q-TOF/MS分析方法
将50 μL精油溶解于1.45 mL正己烷中,进行GC-Q-TOF/MS检测。
色谱柱为HP-5石英毛细柱(30 m×0.25 mm×0.25 μm);升温程序为60 ℃保持5 min,以4 ℃/min升至280 ℃,保持2 min。载气为氦气,流速1.0 mL/min。进样量0.3 μL,分流比为30∶1。
电子轰击离子源,电子能量70 eV,传输线温度280 ℃,离子源温度230 ℃,采样频率50 Hz,采样模式为全扫描,激活电压1.5 V,质量扫描范围m/z 50~500。以正构烷烃为参照计算保留指数用于未知化合物的定性[15]。
1.3.5 抗氧化活性测定方法
DPPH自由基清除能力测定。DPPH自由基清除率的测定参照Reis等[16]的方法并稍做修改。将100 μL不同浓度的精油- 乙醇溶液与等体积DPPH-乙醇溶液(0.2 mmol/L)混合。在室温下避光反应30 min,用酶标仪于517 nm波长处测量吸光度,并以维生素E的抗氧化活性作为对照。
ABTS阳离子自由基清除能力测定。ABTS阳离子自由基清除率的测定参照Re等[17]的方法并稍做修改。ABTS阳离子溶液(7 mmol/L)和过硫酸钾溶液(2.45 mmol/L)等比例混合,室温黑暗条件下反应16 h,用无水乙醇稀释至在734 nm波长处吸光度为0.700±0.05,制备得到ABTS阳离子储备液。取100 μL不同质量浓度梯度精油- 乙醇溶液与等体积ABTS阳离子储备液混合,室温下避光反应5 min,于734 nm波长处测定吸光度,并以维生素E的抗氧化活性作为对照。
1.3.6 抑菌活性测定方法
在Meriem等[18]的方法上做改进,检测4种精油样品对白色念珠菌(Candida albicans)、大肠杆菌(Escherichia coli)和金黄色葡萄球菌(Staphylococcus aureus)的抑制作用。具体操作为:SDB用于活化白色念珠菌,MHB用于活化大肠杆菌和金黄色葡萄球菌。活化后的白色念珠菌、大肠杆菌和金黄色葡萄球菌用麦氏比浊仪将其浓度分别调至0.5麦氏浓度。MHA用于大肠杆菌和金黄色葡萄球菌培养,SDA用于白色念珠菌培养,取100 μL活化好的菌液于平板上,均匀涂布并干燥,等间距放置4个空白药敏纸片(直径6 mm),依次滴加10 μL精油-DMSO溶液(25 mg/mL)。在37 ℃培养箱中培养24 h,测量记录抑菌圈直径的大小,以mm为单位,每组实验重复3次。氨苄青霉素及两性霉素B为阳性对照,DMSO为阴性对照。
1.4 数据处理
所有实验重复测定3次,实验结果以平均值±标准差表示。采用SPSS 23.0软件进行单因素方差分析,Origin 8.5及Excel 用于图表绘制。
2 结果与分析
2.1 干燥方法对欧薄荷精油产率的影响
不同干燥方法对欧薄荷精油产率影响见图1。由图1可知,在不同干燥方法下精油的产率有显著差异(P< 0.05)。阴干欧薄荷精油产率最高(0.49%±0.01%),其次是烘干(0.42%±0.03%)和晒干(0.19%±0.02%)。这与先前的研究结果相似[19-20],经晒干处理过的欧薄荷都有着较低精油产率,可能与在阳光的高温暴晒下导致精油的大量流失有关[21]。

图1 不同干燥方法对欧薄荷精油产率的影响
Fig.1 Effect of different drying methods on yield of essential oil from Mentha longifolia L.
2.2 干燥方法对欧薄荷精油化学成分的影响
不同干燥方法制备的欧薄荷精油成分及含量变化分析结果见表1。因GC-Q-TOF/MS线性范围窄,故采用GC-FID检测各组分相对含量。通过保留指数(RI)及MS图谱,共确定了44种化合物。阴干欧薄荷精油成分40种、烘干38种、晒干44种、新鲜欧薄荷精油35种,其中31种化合物为共有峰,包括14种烯烃类、7种醇类、8种醛酮、1种酯类及1种烷烃类化合物。精油以醛酮(56.73%~58.82%)和烯烃类(35.44%~38.63%)为主。主成分均为香芹酮(46.58%~50.75%)、柠檬烯(24.01%~29.71%)、E-薄荷酮(4.03%~5.13%)、E-石竹烯(4.5%~6.75%)和Z-二氢香芹酮(1.9%~14.6%),这与Younis等[22]对苏丹地区及Koliopoulos 等[23]对希腊地区欧薄荷精油主成分的研究结果相似,但含量上有差异,说明精油成分及含量同样也受生长环境影响。与新鲜欧薄荷精油相比较,经阴干和晒干法处理过的欧薄荷,其精油主成分柠檬烯和E-石竹烯含量有显著性变化(P< 0.05),柠檬烯含量不同程度上有所减少,而E-石竹烯含量有所增加,烘干药材精油中,两者含量变化差异不显著。此外,3种干燥方法对香芹酮、E-薄荷酮和Z-二氢香芹酮的含量均有显著性影响。香芹酮、E-薄荷酮及Z-二氢香芹酮含量均不同程度降低,阴干和烘干中Z-二氢香芹酮含量增加。
表1 不同干燥方法制得的欧薄荷精油化学成分组成
Tab.1 Chemical compositions of essential oil from Mentha longifolia L. with different drying methods

序号计算RI文献RI化合物相对含量/%阴干烘干晒干新鲜确定方法1933929α-侧柏烯0.380.270.260.29RI, MS2972974香桧烯0.240.230.180.23RI, MS3991991月桂烯0.150.170.140.16RI, MS410291030柠檬烯28.3129.6824.0129.71RI, MS510381038E-罗勒烯1.001.090.700.99RI, MS610491049Z-罗勒烯0.340.360.240.34RI, MS710881090对甲-α-甲基苯乙烯0.030.030.040.03RI, MS811351131波斯菊萜——0.03—RI, MS913771375异喇叭烯0.210.180.270.65RI, MS1013861384β-波旁烯0.810.781.20—RI, MS1114081406Z-石竹烯0.040.030.05—RI, MS1214211419E-石竹烯5.174.746.754.7RI, MS1314311432β-胡椒烯0.070.060.120.6RI, MS1414461448异大根香叶烯0.040.030.060.03RI, MS1514561454蛇麻烯0.180.090.120.09RI, MS1614831481D-大根香叶烯1.020.790.980.69RI, MS1715261524杜松烯0.170.160.290.12RI, MS18995994异戊二醇0.070.060.060.09RI, MS1910311032桉叶油醇0.090.090.080.11RI, MS2011201123E-薄荷基-2,8-二烯-1-醇0.14—0.04—RI, MS2111721174L-薄荷醇0.030.060.250.56RI, MS2211901190α-松油醇0.120.130.180.12RI, MS2311941195二氢香芹醇—0.170.050.17RI, MS2412201217E-香芹醇0.250.411.460.20RI, MS2512331229Z-香芹醇0.090.130.260.11RI, MS2614581457E-橙花叔醇0.220.180.220.16RI, MS2715801576油烯醇0.03—0.140.06RI, MS282113—3,7,11,15-四甲基-2-十六烯-1-醇0.030.020.03—MS2910431045苯乙醛——0.930.08RI, MS3012001201藏红花醛——0.07—RI, MS31127312792-苯基-2-丁烯醛0.180.180.03—RI, MS3211541154E-薄荷酮4.944.035.025.13RI, MS3311641164Z-薄荷酮0.260.240.270.29RI, MS3411961195Z-二氢香芹酮4.63.881.912.13RI, MS3512041201E-二氢香芹酮0.220.330.060.09RI, MS3612401237长叶薄荷酮1.801.800.920.22RI, MS3712481242香芹酮46.5846.648.1150.75RI, MS
续表1

序号计算RI文献RI化合物相对含量/%阴干烘干晒干新鲜确定方法3812551255香芹烯酮0.050.050.150.11RI, MS3913991394茉莉酮0.130.130.190.10RI, MS4013641362Z-乙酸香芹酯0.180.170.150.10RI, MS4111771179E-4,5-环氧蒈烷0.04—0.040.04RI, MS4213581357丁香酚0.040.080.03—RI, MS4314991495β-环庚烷0.640.50.560.39RI, MS4415861581石竹烯氧化物0.070.030.19—RI, MS合计98.9697.9696.8499.64
—表示未测出。
干燥后的欧薄荷精油中的化合物的种类数较干燥前均有所增加,其中2-苯基-2-丁烯醛、丁香酚、β-波旁烯、E-石竹烯、石竹烯氧化物和3,7,11,15-四甲基-2-十六烯-1-醇等6种成分,在新鲜欧薄荷精油中未检测出,但在经阴干、烘干和晒干处理后的欧薄荷精油中均有检测出。表面上看,持续的干燥对这些化合物的合成和积累有促进作用。
2.3 干燥方法对欧薄荷精油抗氧化活性的影响
DPPH自由基和ABTS阳离子自由基清除实验结果表明:4种欧薄荷精油具有一定的抗氧化活性,4种精油在两种测定方法下均呈现一致的结果,表现为经阴干、40 ℃烘干及晒干3种干燥处理的欧薄荷,其精油对ABTS阳离子和DPPH自由基清除能力无显著差异,但都远远高于新鲜欧薄荷精油。精油抗氧化活性是其多种组成成分协同作用的结果,精油中的微量成分与主要成分间的协同作用,也可有效加强抗氧化活性[24]。干燥后的3种欧薄荷精油抗氧化活性均有所增强,可能与干燥后精油中化合物种类增加有关。
表2 不同干燥方法欧薄荷精油的抗氧化活性
Tab.2 Antioxidant activities of essential oil from Mentha longifolia L. with different drying methods mg/mL

IC50阴干烘干晒干新鲜维生素E ABTS+·1.20±0.04a1.09±0.04a1.08±0.02a6.89±0.17b0.016±0.001DPPH·9.28±0.32a9.55±0.21a9.10±0.13a14.94±0.4b0.028±0.001
同行上标不同字母代表组间有显著性差异(P<0.05)。
2.4 干燥方法对欧薄荷精油抑菌活性的影响
通过白色念珠菌、大肠杆菌和金黄色葡萄球菌3种菌,评估了干燥方法对精油抑菌活性的影响,结果见图2。
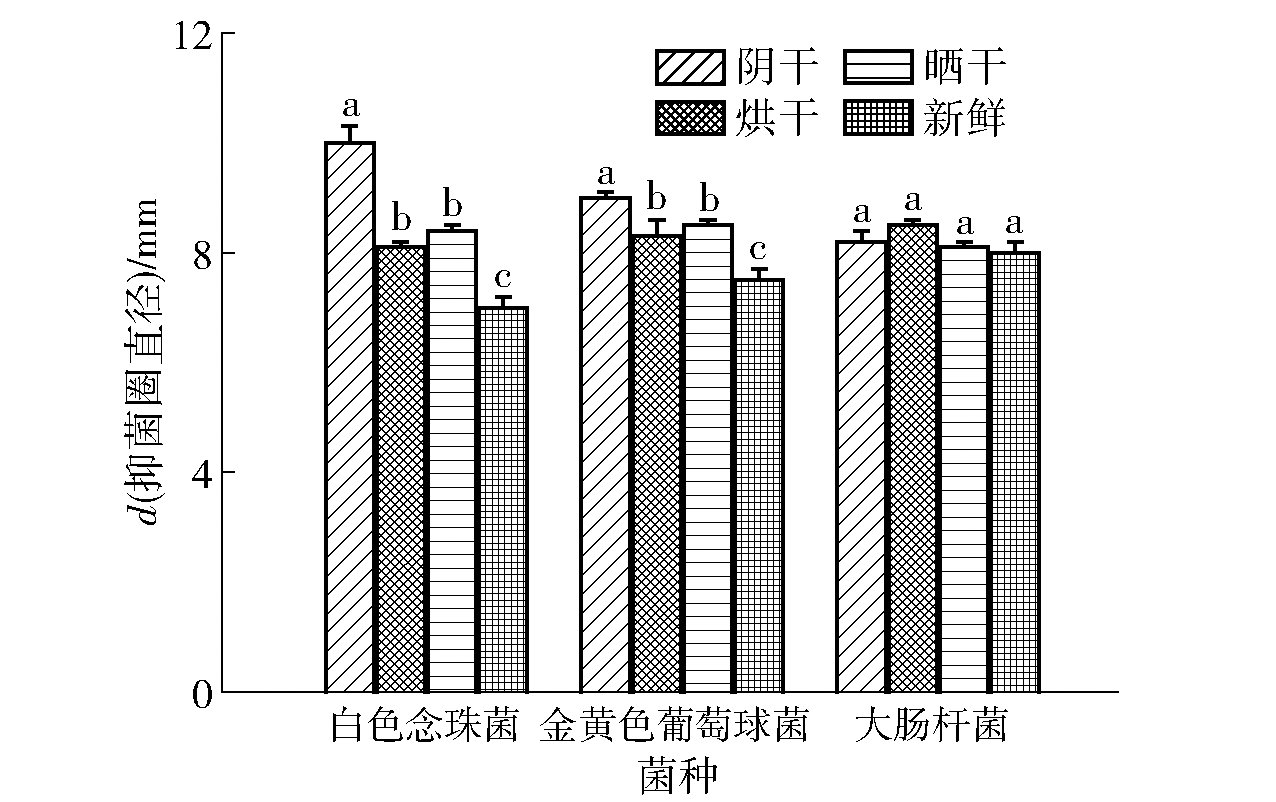
不同字母代表组间显著性差异,P<0.05。
图2 不同干燥方法欧薄荷精油的抑菌活性
Fig.2 Antibacterial activities of essential oil from Menthalongifolia L. with different drying methods
精油的抗菌活性也主要取决于其化学组成及含量,其中酚类、萜醇、酮、醛以及甾醇类等均为抗菌活性成分的重要组成 [25-27]。抑菌结果显示,阴干欧薄荷精油对白色念珠菌和金黄色葡萄球菌的抑菌活性明显高于经40 ℃烘干、晒干及新鲜欧薄荷精油,其中新鲜欧薄荷精油对白色念珠菌和金黄色葡萄球菌的抑制作用最弱。4种精油对白色念珠菌和金黄色葡萄球菌的抑菌作用由高到低则依次为阴干、晒干、烘干和新鲜。此外,4种精油样品对大肠杆菌的抑制作用无显著性差异。
3 结 论
不同干燥方法对欧薄荷精油的产率、组成成分、含量以及其抗氧化、抗菌活性均有影响。在3种不同的干燥条件下,其精油产率从高到低依次是阴干、烘干、晒干和新鲜。4种样品中共检测出44个化合物,阴干欧薄荷精油40种,烘干38种,晒干44种,新鲜35种,其中31种化合物为共有峰。包括14种烯烃类、7种醇类、8种醛酮、1种酯类及1种烷烃类化合物。抗氧化和抑菌实验表明:4种欧薄荷精油对ABTS阳离子自由基和DPPH自由基均具有一定的清除作用,且经阴干、40 ℃烘干及晒干等3种干燥处理后的欧薄荷,其精油对ABTS阳离子自由基和DPPH自由基的清除能力显著强于新鲜欧薄荷精油。同时,4种精油均对白色念珠菌、金黄色葡萄球菌和大肠杆菌均有一定的抑制作用。但阴干精油对白色念珠菌和金黄色葡萄球菌的抑制作用明显高于其他3种精油。因此,结合精油产率及抑菌活性,阴干法是欧薄荷较佳的干燥方式。
[1] 陈观卿,童光森. 消暑薄荷茶的配方工艺研究[J]. 现代食品, 2020(11):83-85.
CHEN G Q, TONG G S. The formulation technology research of mint tea[J]. Modern Food, 2020(11): 83-85.
[2] 热孜万古力,张彦福. 维吾尔药欧薄荷本草考证[J]. 中国民族民间医药杂志, 1998(3): 35-36.
REZIWANGULI, ZHANG Y F, The textual research of Mentha Longifolia: an Uygur medicines[J]. Chinese Journal of Ethnomedicine Ethnopharmacy, 1998(3): 35-36.
[3] DRAGANA S, SOFIJA D, MARINA M, et al. Antimicrobial and antioxidant activity of the essential oils obtained from Mentha longifolia L. Hudson, dried by three different techniques[J]. Records of Natural Products, 2014,8(1): 61-65.
[4] MAKVANDI M, SHOKOOHIZADEH L, MIRZAEE M. Antibacterial and drug synergistic activities of Mentha longifolia essential oil against Shigella flexneri and Shigella sonnei[J]. 2017, 5(3):92-95.
[5] DADKHAH A, FATEMI F, RASOOLI A, et al. Assessing the effect of Mentha longifolia essential oils on COX-2 expression in animal model of sepsis induced by caecal ligation and puncture[J]. Pharmaceutical Biology, 2018,56(1): 495-504.
[6] GHADER J A, MASSOUD M, BAHRAM D, et al. Effects of Mentha longifolia essential oil on ruminal and abomasal longitudinal smooth muscle in sheep[J]. Journal of Essential Oil Research, 2012,24(1): 61-69.
[7] GUO Y R, AN Y M, JIA Y X, et al. Effect of drying methods on chemical composition and biological activity of essential oil from cumin (Cuminum cyminum L.)[J]. Journal of Essential Oil-Bearing Plants, 2018,21(5): 1295-1302.
[8] RODRIGO O S, CONSUELO D M, SOLEDAD P C, et al. Viability of pre-treatment drying methods on mango peel by-products to preserve flavouring active compounds for its revalorisation[J]. Journal of Food Engineering, 2020, 279: 109953.
[9] 康显杰,杜伟锋,凌珏,等. 3种干燥方法对片姜黄挥发油的影响[J].中成药, 2017,39(9): 1900-1903.
KANG X J, DU W F, LING Y, et al. Effects of three drying methods on volatile oil of Curcuma longa[J]. Chinese Traditional Patent Medicine, 2017,39(9): 1900-1903.
[10] LLORENS-MOLINA J A, VACAS S, CASTELL V, et al. Seasonal variations of essential oils from five accessions of Mentha longifolia (L.) L. with selected chemical profiles[J]. Journal of Essential Oil Research, 2020, 32(5):419-428.
[11] BA ER K H C, KÜRKÇÜO
ER K H C, KÜRKÇÜO LU M, DEMIRCI B, et al. Essential oils of Mentha species from Marmara region of Turkey[J]. Journal of Essential Oil Research, 2012,24(3):265-272.
LU M, DEMIRCI B, et al. Essential oils of Mentha species from Marmara region of Turkey[J]. Journal of Essential Oil Research, 2012,24(3):265-272.
[12] IQBAL T, HUSSAIN A I, CHATHA S A, et al. Antioxidant activity and volatile and phenolic profiles of essential oil and different extracts of wild mint (Mentha longifolia) from the Pakistani Flora[J]. Journal of Analytical Methods in Chemistry, 2013:536490.
[13] ABDEL-HAMEED E S, SALMAN M S, FADL M A, et al. Chemical composition and biological activity of Mentha longifolia L. essential oil growing in Taif, KSA extracted by hydro-distillation, solvent free microwave and microwave hydro-distillation[J]. Journal of Essential Oil Bearing Plants, 2018, 21(1):1-14.
[14] SOUSA M H O, MORGAN J M S, CESCA K, et al. Cytotoxic activity of Cunila angustifolia essential oil[J]. Chemistry & Biodiversity, 2020,17(2): e1900656.
[15] 随新平,朱庆珍,张宁,等. 阿胶的香气活性物质分析[J].食品科学技术学报, 2021,39(3): 89-100.
SUI X P, ZHU Q Z, ZHANG N, et al. Analysis of aroma active compounds of Ejiao[J]. Journal of Food Science and Technology, 2021,39(3): 89-100.
[16] REIS F S, MARTINS A, BARROS L, et al. Antioxidant properties and phenolic profile of the most widely appreciated cultivated mushrooms: a comparative study between in vivo and in vitro samples[J]. Food and Chemical Toxicology, 2012,50(5): 1201-1207.
[17] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999,26(9/10): 1231-1237.
[18] MERIEM A, HOURIA M, ASSIA A, et al. Algerian Mentha pulegium L. leaves essential oil: chemical composition, antimicrobial, insecticidal and antioxidant activities[J]. Industrial Crops & Products, 2016,94: 197-205.
[19] 唐文文,李国琴,晋小军. 不同干燥方法对当归挥发油成分的影响[J]. 中国实验方剂学杂志, 2014,20(3): 9-12.
TANG W W, LI G Q, JIN X J. Effects of different drying methods on volatile oil components of Angelica sinensis[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2014,20(3): 9-12.
[20] 马雯芳,余娇,邓慧连,等.不同干燥方法对假蒟挥发油成分影响的研究[J].中成药,2013,35(6):1270-1274.
MA W F, YU J, DENG H L,et al. Effect of different drying methods on the constituents of essential oil from Piper sarmentosum R.[J]. Chinese Traditional Patent Medicine, 2013,35(6):1270-1274.
[21] MOHAMMAD B H, ABBAS H, LAMIA V, et al. Drying method affects essential oil content and composition of basil (Ocimum basilicum L.) [J]. Journal of Essential Oil-Bearing Plants, 2010,13(6): 759-766.
[22] YOUNIS M H, BESHIR Y S M. Carvone-rich essential oils from Mentha longifolia (L.) Huds. ssp. schimperi Briq. and Mentha spicata L. grown in Sudan[J]. Journal of Essential Oil Research, 2004, 16(6):539-541.
[23] KOLIOPOULOS G, PITAROKILI D, KIOULOS E, et al. Chemical composition and larvicidal evaluation of Mentha, Salvia, and Melissa essential oils against the West Nile virus mosquito Culex pipiens[J]. Parasitology Research, 2010, 107(2):327-335.
[24] ALMADIY A A, NENAAH G E, ALASSIUTY B A, et al. Chemical composition and antibacterial activity of essential oils and major fractions of four Achillea species and their nanoemulsions against foodborne bacteria[J]. LWT-Food Science and Technology, 2016, 69: 529-537.
[25] ABDELLI M, MOGHRANI H, ABOUN A, et al. Algerian Mentha pulegium L. leaves essential oil: chemical composition, antimicrobial, insecticidal and antioxidant activities[J]. Industrial Crops and Products, 2016, 94: 197-205.
[26] VALLVERDU-QUERALT A, REGUEIRO J, MARTINEZ-HUELAMO M, et al. A comprehensive study on the phenolic profile of widely used culinary herbs and spices: rosemary, thyme, oregano, cinnamon, cumin and bay[J]. Food Chemistry, 2014, 154: 299-307.
[27] RIAHI L, ELFERCHICHI M, GHAZGHAZI H, et al. Phytochemistry, antioxidant and antimicrobial activities of the essential oils of Mentha rotundifolia L. in Tunisia[J]. Industrial Crops and Products, 2013, 49: 883-889.