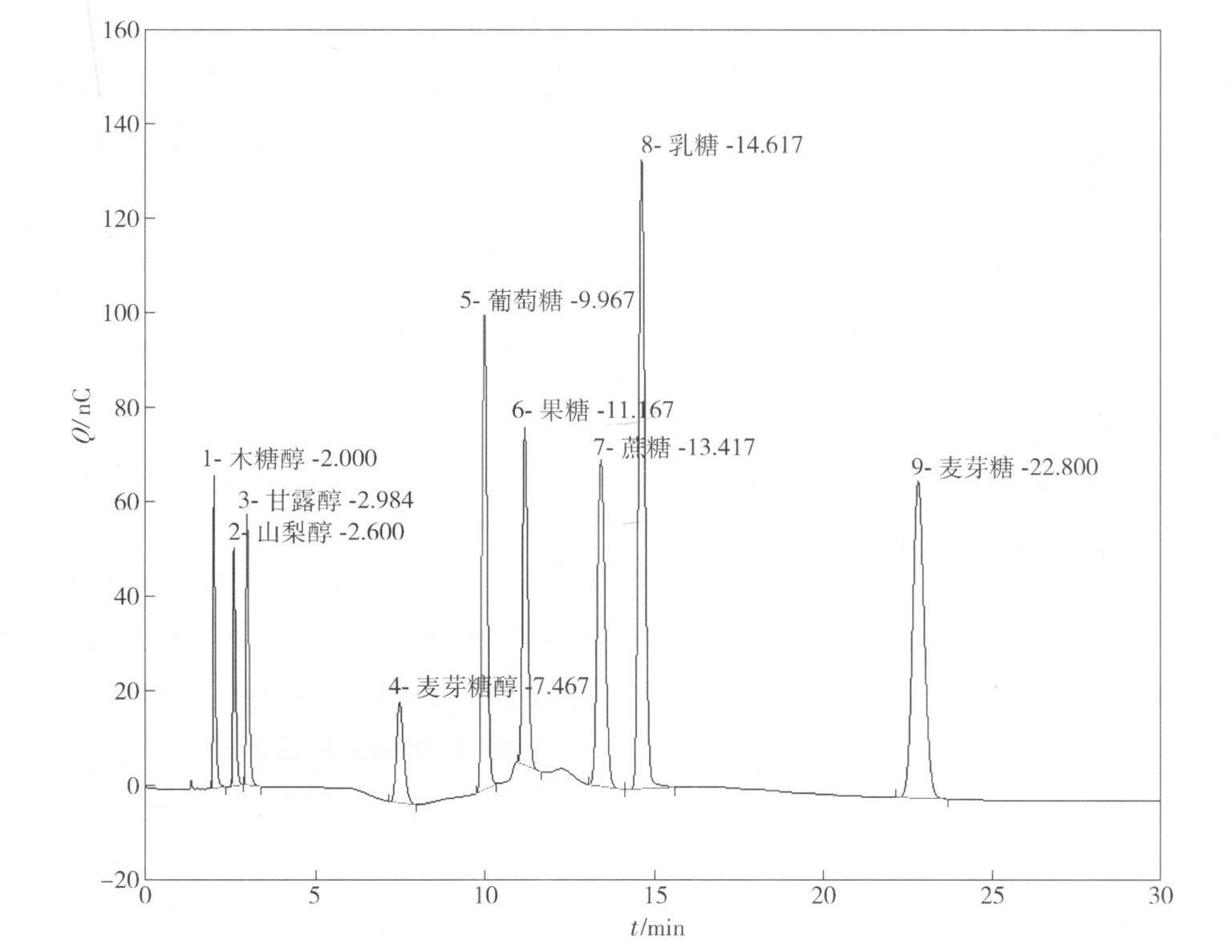
1.木糖醇 2.山梨醇 3.甘露醇 4.麦芽糖醇 5.葡萄糖 6.果糖 7.蔗糖 8.乳糖 9.麦芽糖
图1 混合标准物质的色谱图
Fig.1 Chromatogram of mixed standards
文章编号: 1671-1513(2010)04-0061-04
刘玉峰, 唐华澄, 李 东
(北京市营养源研究所 分析室, 北京 100069)
摘 要: 建立了离子色谱法定量测定食品中糖和糖醇的方法,应用CarboPac TM PA1 (4 mm×250 mm)阴离子交换柱,NaOH淋洗液梯度淋洗,脉冲安培检测器检测. 6次测定平行样品,相对标准偏差为2.53%~4.57%,糖和糖醇的加标回收率在96%~101%之间,方法简单快捷,适用于食品中糖和糖醇的检测.
关键词: 高效离子色谱法; 脉冲安培检测; 糖; 糖醇
国标方法GB/T 22221—2008《食品中果糖、葡萄糖、蔗糖、麦芽糖和乳糖的测定高效液相色谱法》 [1] 和GB/T 22222—2008《食品中木糖醇、山梨醇和麦芽糖醇的测定高效液相色谱法》 [2] 的实施,为食品中糖和糖醇的定量检测提供了一个方便、快捷、准确的方法,然而,使用氨基色谱柱,高效液相色谱仪测定糖和糖醇时,会出现糖和糖醇分离不太好的情况,当食品中木糖醇和葡萄糖、麦芽糖和麦芽糖醇同时存在时,如果选用的氨基色谱柱不合适,糖和糖醇就可能分不开 [3] ,实验人员就会选择不同品牌的色谱柱去完成实验 [4-5] ,产生了较多的工作量,而采用离子色谱法,就不会给操作者带来困扰,同时提高了检出限. 本文参考AOAC Official Method 995.13 [6] 和AOAC Official Method 2000.17 [7] ,同时完成了果糖、葡萄糖、蔗糖、麦芽糖、乳糖、木糖醇、山梨醇、甘露醇和麦芽糖醇的分离.
1.1.1 仪器
ICS-3000离子色谱仪,脉冲安培检测器,Au电极.
1.1.2 标准物质与试剂
单双糖标准物质:葡萄糖(Fluka)、果糖(Fluka)、乳糖(Fluka)、蔗糖(Fluka)、麦芽糖(Fluka);糖醇标准:木糖醇(Sigma)、山梨醇(Sigma)、甘露醇(Sigma)、麦芽糖醇(Sigma);试剂:50%NaOH(Fluka),磺基水杨酸.
1.1.3 标准溶液的配制
称取经过干燥的木糖醇0.025 g、山梨醇0.025 g、甘露醇0.025 g、麦芽糖醇0.025 g、葡萄糖0.025 g、果糖0.075 g、蔗糖0.125 g、乳糖0.100 g、麦芽糖0.125 g(精确至0.01 mg)置25 mL容量瓶,加水溶解定容,每mL溶液中有1.00 mg木糖醇、1.00 mg山梨醇、1.00 mg甘露醇、1.00 mg麦芽糖醇、1.00 mg葡萄糖、3.00 mg果糖、5.00 mg蔗糖、4.00 mg乳糖、5.00 mg麦芽糖.
准确称量1 g(精确至0.1 mg)样品(称样量根据糖和糖醇的含量适当增减),加入约50 mL80 ℃蒸馏水,80 ℃水浴振摇20 min,冷却至室温,加入20 mL 3%磺基水杨酸溶液,用蒸馏水定容至100 mL,静置15 min,过滤,滤液依次过0.45 μm水相滤膜、RP柱、0.45 μm水相滤膜(根据工作曲线的线性范围确定是否将滤液进行稀释).
色谱工作条件:
1) 梯度洗脱程序
色谱柱:Carbopac TM PA1,4 mm×250 mm(带CarboPac TM PA1 4 mm×50 mm保护柱).
柱温:30 ℃;
淋洗液:0~5 min,20 mmol/L NaOH;5~12 min,20 mmol/L~200 mmol/L NaOH;12~30 min,200 mmol/L NaOH;30.1~45 min,20 mmol/L NaOH;
流速:1 mL/min;
进样量:10 μL.
2) 检测器波形
0.00 s,0.10 V;0.20 s,0.10 V,开始积分;0.40 s,0.10 V,积分结束;0.41 s,-2.00 V;0.42 s,-2.00 V;0.43 s,0.60 V;0.44 s,-0.10 V;0.50 s,-0.10 V.
本文使用Carbopac TM PA1色谱柱,选择等度洗脱,淋洗液浓度为200 mmol/L NaOH时,麦芽糖醇和果糖分离不好,其他8种物质都可以实现等度洗脱. 为了实现麦芽糖醇和果糖的分离,不断优化淋洗条件,发现低浓度淋洗对弱保留物质保留时间的影响不是很大,但是明显影响了其他物质的保留时间,因此如果使用低浓度等度淋洗,强保留物质出峰时间太长,不适用于日常检测,最后确定了梯度洗脱. 在梯度洗脱的过程中,蔗糖和乳糖的出峰顺序也发生了改变. 标准物质的分离见图1.

1.木糖醇 2.山梨醇 3.甘露醇 4.麦芽糖醇 5.葡萄糖 6.果糖 7.蔗糖 8.乳糖 9.麦芽糖
图1 混合标准物质的色谱图
Fig.1 Chromatogram of mixed standards
谱图表明,采用该方法对糖醇和单双糖可以进行有效的分离.
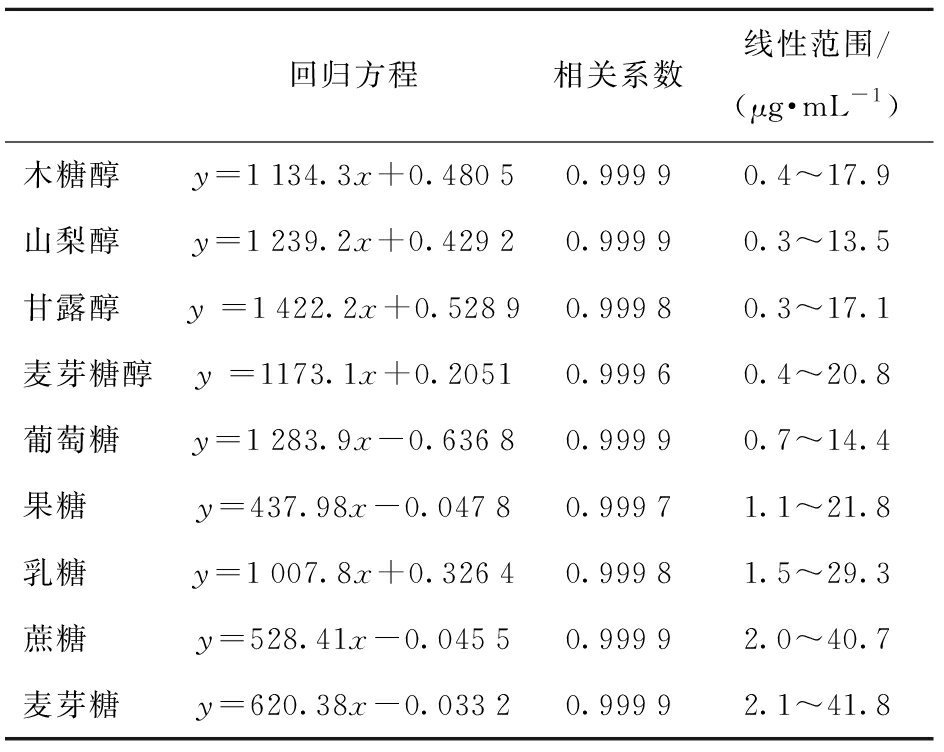
配制一系列浓度的混合标准工作液依次进样,以峰面积为纵坐标,浓度为横坐标,制作标准曲线,结果表明,这九种糖和糖醇都有很好的线性回归和较宽的线性范围,见表1.
采用脉冲安培检测器,进样10 μL,根据3倍信噪比( S / N =3)可分别计算出9种糖和糖醇的检出限分别为质量浓度1,1,1,1,1,1,1,2和2 μg/g.
本文对苹果、芹菜、木糖醇酸牛奶、饮料样品等进行了检测分析,结果表明,该方法操作简单,检出限远远高于液相色谱法,可行性好.
表1 9种糖和糖醇的标准曲线
Tab.1 Standard curve of nine sugars and sugar alcohols
查阅资料可知,一般蛋白沉淀剂选用盐、酸、乙醇、乙腈,本文从样品类型、淋洗液、色谱柱等方面考察了沉淀剂的选择. 由于离子色谱使用的色谱柱是离子交换柱,所以在样品处理过程中要避免离子的带入,所以选用盐做沉淀剂是不可行的. 另外,该方法使用了CarboPac TM PA1 色谱柱,该色谱柱有机溶剂的兼容性最大,质量百分数为2%,因此,乙腈也不是合适的沉淀剂. 乙醇的沉淀能力不太强,因此本文选用酸做沉淀剂,但是强酸会分解部分双糖和低聚糖,通过实验,本文确定了质量百分数为3%的磺基水杨酸作为沉淀剂.
准确称取苹果、山楂果肉饮料、酸奶各6份,经相同的前处理后,测定结果见表2.
准确称取1.000 0 g山楂果肉饮料3份,分别加入山梨醇5 mg、甘露醇0.5 mg、葡萄糖20 mg、果糖50 mg、蔗糖20 mg,每个样品重复测定3次,测定回收率. 得到结果,平均回收率在96%~101%之间.
表2 精密度结果
Tab.2 Precision results g/100 g
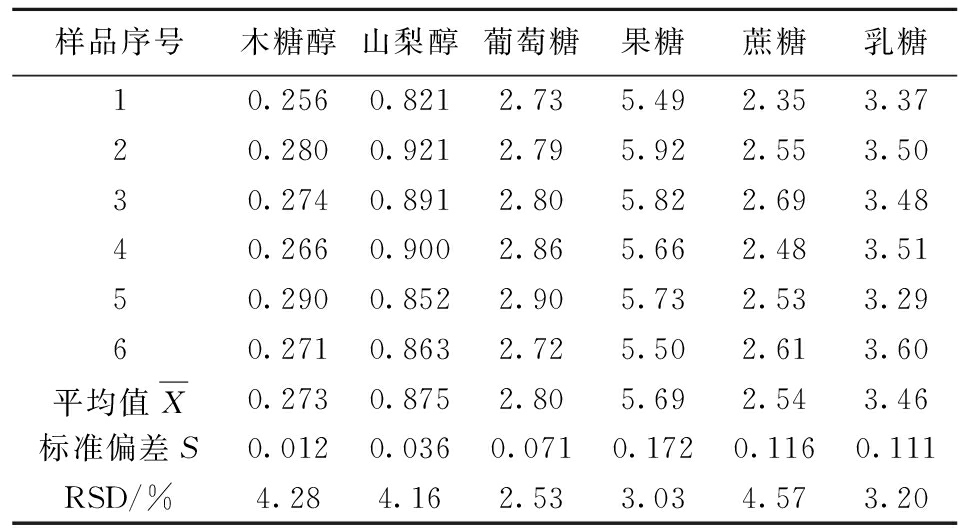
注:RSD为相对标准偏差.
本方法仅适用于添加了糖和糖醇的食品以及植物水果中天然存在的糖和糖醇的检出,目前市场上一些食品不一定添加了本文所提及的所有糖和糖醇,如果样品中没有添加麦芽糖醇,可以采用200 mmol/L NaOH等度洗脱,否则必须采用梯度洗脱. 在实际样品测定过程中,本方法表现了较好的重现性和较高的准确度,以及较高的检出限.
参考文献:
[1] GB/T 22221—2008. 食品中果糖、葡萄糖、蔗糖、麦芽糖和乳糖的测定高效液相色谱法[S]. 北京:中国标准出版社,2008.
[2] GB/T 22222—2008. 食品中木糖醇、山梨醇和麦芽糖醇的测定高效液相色谱法[S]. 北京:中国标准出版社, 2008.
[3] 马立田,王式箴. 高效液相色谱法测定低热量食品中的葡萄糖、果糖、蔗糖、麦芽糖醇和山梨糖醇的研究[J]. 食品与发酵工业,1998,24(4):12-17.
[4] 吴莉,周红. 应用氨基柱测定奶粉中的糖份[J]. 武汉化工学院学报,2002,24(2):4-5.
[5] 甘宾宾,蒋世琼. 食品中糖类的高效液相色谱法测定[J]. 分析仪器, 2000(3):38-41.
[6] AOAC Official Method 995.13. Carbohydrates in Soluble (Instant) Coffee Anion-Exchange Chromatographic Method with Pulsed Amperometric Detection First Action[S]. 1995.
[7] AOAC Official Method 2000.17 Determination of Trace Glucose and Fructose in Raw Cane Sugar High-Performance Anion-Exchange Chromatography First Action[S]. 2000.
LIU Yu-feng, TANG Hua-cheng, LI Dong
( Laboratory Department of Beijing Research Institute for Nutritional Resources , Beijing 100069)
Abstract: A method was established to determine sugars and sugar alcohols in foods by using ion exchange chromatography with pulsed amperometric detector. The samples were separated on a CarboPac PA1 (4 mm×250 mm) anion exchange column using gradient elution of sodium hydroxide. The relative standard deviation of this method is 2.53%~4.57% and the recovery is in the range of 96%~101%. The method is fit for rapid detection of sugars and sugar alcohols in foods.
Key words: high performance ion exchange chromatography(HPIEC); pulsed amperometric detector(PAD); sugar; sugar alcohols
通讯作者 .
作者简介: 刘玉峰(1972—),女,山西兴县人,助理研究员,硕士,主要从事食品营养成分分析检测方面的研究; 李 东(1964—),男,河北怀安人,教授级高工,博士,主要从事食品营养分析和营养干预方面的研究.
基金项目: 北京市科技计划项目(促进科研院所发展,建设新型科研体系重大专项);2008年北京市科学技术研究院创新团队项目.
收稿日期: 2010-05-20
文献标志码: A
中图分类号: TS207.3
(责任编辑:邓清燕)